La fracción biótica de la aceituna en la calidad de los aceites de oliva vírgenes: la 'invisible' tergiversación y destrucción de su flavor, propiedades y atributos
Alfonso Montaño1; amontano@ctaex.com; @alfonsoleologo
Sofía Redondo Redondo1;
Fátima Chamizo2,
1 Centro Tecnológico Nacional Agroalimentario 'Extremadura', CTAEX
2 Compañía de investigación y Producción Agroalimentaria, CEINPASA
26/09/2022Para nadie es desconocida la fracción abiótica de los aceites de oliva, compuesta por una mezcla en la que predomina mayoritariamente triglicéridos, y en menor medida, mono y diglicéridos, ácidos grasos libres y fosfolípidos que suponen aproximadamente el 98% de su composición. A esa fracción mayoritaria se suma un complejo grupo moléculas que les otorgan sus propiedades sensoriales, nutricionales, antioxidantes, de color, etc. como son los esteroles, ceras, alcoholes triterpénicos, escualeno, tocoferoles…hasta un total que superan los 200 compuestos. La forma 'perfecta' del zumo de aceituna sería aquella que poseyera un aroma a fruto sano, bajo valores en los parámetros de calidad fisicoquímica y una ausencia de defectos (olores que no nos recuerda a frutos sanos). Sin embargo, en la vida comercial de los aceites, estos están sujetos a procesos oxidativos, hidrolíticos, polimerización, etc., que conllevan el deterioro de sus propiedades. En ocasiones este deterioro se percibe y se detecta sensorialmente en los aceites con olores que identificamos como 'atrojado', 'moho', 'tierra', 'avinagrado' o 'rancio' junto a evoluciones negativas de los parámetros fisicoquímicos. Varias de estas reacciones estarían influenciadas o determinadas por la fracción biótica presente en los aceites de oliva vírgenes, no solo en postcosecha sino incluso en los aceites de oliva vírgenes envasados. E incluso, no se podría descartar que algunos microrganismos favorecieran las características sensoriales y/o nutricional de los aceites en su proceso de elaboración y/o postelaboración.
En este artículo se va a hacer una revisión del peso de la fracción biótica (levaduras, hongos y bacterias) que podrían influenciar (tergiversar) propiedades de los aceites de oliva vírgenes, favorecer la aparición de defectos sensoriales y reducir a la vida comercial de éstos.

Introducción
Son muchos los estudios, trabajos y proyectos que han analizado los efectos de parámetros culturales, de postcosecha y procesos sobre las características sensoriales, contenidos en antioxidantes y otras propiedades de los aceites de oliva vírgenes. Sin embargo, no se ha considerado lo suficiente de un factor 'invisible' al ojo humano, y que sin duda tiene más influencia sobre el producto final de lo que la investigación le ha otorgado: los microorganismos que conforman la fracción biótica de la aceituna y la almazara.
La industria olivarera y oleícola, a diferencia de otras industrias alimentarias, como las que trabajan con otros tipos de frutos, no ha considerado nunca el control microbiológico de sus productos ni siquiera sus procesos; y por desgracia, en muchos de los casos, ni en las condiciones higiénicas de la almazara (García-Mesa y Sánchez-Ortíz, 2017). Todo ello conlleva una pérdida de control de las contaminaciones microbiológicas que puedan tener lugar durante el proceso de elaboración, lo que viene como consecuencia de que el sector habitualmente no sea consciente de que la carga microbiana epifita de la aceituna, junto con la desarrollada tras la recepción, es un riesgo para el proceso y, sobre todo, la calidad final de los productos que elabora.
En este artículo se pretende dar una visión de cómo los microrganismos, sus enzimas y sus metabolitos pueden provocar no solo una 'desviación' de sus propiedades sensoriales o fisicoquímicas, sino una pérdida da calidad total tanto en el campo como en la misma botella. Aun así, el cómo afecta a la calidad del aceite la presencia epifita, así como ésta evoluciona, cuantitativa y cualitativamente, a lo largo de los diferentes pasos en la extracción del aceite, no está conocido con claridad, siendo un interesante campo de investigación para mejorar la calidad de los aceites de oliva vírgenes.
Defectos sensoriales relacionados con microorganismos
El Aceite de Oliva Virgen Extra (AOVE) se caracteriza porque recuerda su aroma y sabor a frutos sanos, aromas agradables provenientes de una mezcla compleja de compuestos aromáticos que, mayoritariamente, provienen de una ruta de defensa de las plantas ante un daño físico: ruta de la lipoxigenasa. Estos compuestos son los responsables de las notas 'verdes', del 'frutado' y que nos evoquen a frutas y verduras sanas en diferentes momentos de su maduración. Sin embargo, diferentes fenómenos pueden alterar este agradable aroma para transformarlo en olores que no evocan a 'cosas' sanas: flavores no propios de frutos sanos, sino artefactos volátiles espurios.
Tanto la biogénesis de compuestos volátiles como la transformación de compuestos fenólicos que generan estos olores, no propios de frutos sanos y que, por ende, hacen perder la categoría 'virgen extra', vienen mayoritariamente por la influencia microbiana. Guerrini et al. (2015) encontraron relaciones directas significativas entre el contenido de hongos y levaduras con la concentración de compuestos volátiles relaciones con defectos sensoriales (etil-acetato, 2-butanona, ácido butírico, pentanol, 2-heptanol, ácido octanóico…) así como inversa con otros compuestos vinculados con los atributos positios (trans-2-hexenal). El efecto negativo de esta flora microbiana podría ser incluso más determinante en la calidad que los habituales parámetros de madurez, tiempo y temperatura de batido, sin que, primero, se haya investigado suficientemente su efecto y, en segundo lugar, se haya debatido directamente de sus consecuencias en la exigencia de una adecuada higiene y limpieza en las almazaras.
Pero, no solo hay que evaluar los microrganismos provocarían la pérdida de la categoría comercial, sino que, como se verá en este artículo, una contaminación 'liviana' podría provocar una pérdida de compuestos volátiles, intensidad, atributos sensoriales y pigmentos. (Vichi et al., 2011).
Síntesis de metabolitos vinculados con el análisis sensorial
Los microorganismos afectarán a la calidad final del aceite, desde su recolección, promovida por la respiración de los frutos que incrementa la temperatura, y el perfecto medio de cultivo por la liberación de jugos por la pérdida integridad física del fruto. En los siguientes pasos del proceso (lavado, conservación en tolva, etc.) se crearán condiciones en las que estos microrganismos generarán sus metabolitos de descomposición y/o libere enzimas que tergiversarán o eliminará los atributos sensoriales positivos del aceite.
Las causas que llevan a los defectos sensoriales en los diferentes pasos del proceso de extracción aún no están bien establecidas, con una escasa bibliografía resultante de pocos estudios que con concreción busca conocer la síntesis de estos compuestos volátiles negativos. No obstante, cada día se conoce más sobre la vinculación de determinados compuestos volátiles que están relacionado con determinadas intensidades y descriptores en cata.
El perfil aromático de los aceites de oliva estaría caracterizado hasta por casi dos centenares de compuestos aromáticos, que son liberados de la matriz oleosa y le otorgan la propiedad inigualable de su perfil sensorial. Gran parte de estos compuestos volátiles, en torno al 65% provendrían de la 'Ruta de la Lipoxigenasa', una cadena de reacción de cuatro enzimas localizados en el mesocarpo de la aceituna (80-90%) y del hueso de la aceituna (20-10%) que, a partir de los ácidos grasos libres linoleico y linolénico, generan compuestos de 5 y 6 átomos de carbono (aldehídos, cetonas, alcoholes, ésteres…) que caracterizan el frutado propio de los AOVE. Muchos de estos compuestos se liberan desde la matriz al aíre o espacio de cabeza, mientras otros podrían solubilizarse y permanecer dentro de dicha matriz participando en las características sensoriales de olor y sabor del producto final.

En los aceites de oliva, en ocasiones, pueden aparecer defectos sensoriales, olores y/o sabores que no son propios de un fruto sano. Este olor y/o sabor puede tener diferentes causas: físicas, químicas o microbiológicas. Estas degradaciones pueden aparecer de forma concomitante, lo que en ocasiones dificulta su identificación y mucho más vincular a un determinado defecto.
Es importante destacar que solo las aceitunas atacadas por plagas, o las caídas al suelo antes de la recolección, producen defectos sensoriales inherentes al fruto. Los otros defectos en los aceites son debido a una recolección y conservación inadecuada de las aceitunas y/o proceso de elaboración y conservación de los aceites resultantes.
Cada defecto sensorial va a estar vinculado a un amplio número de compuestos volátiles y en diferente cuantía; incluso un mismo compuesto en diferente concentración podría estar relacionado con diferentes defectos. A ello hay que sumar que muchos volátiles con un umbral de detección alto implican que hace falta mucha concentración de éstos para su percepción y detección.
A continuación, se describirá el origen y causas de los principales defectos sensoriales en lo aceites de oliva y en los que la fracción biótica tienen una elevada influencia. No obstante, es importante anotar que la existencia de una relación entre una determinada especie de microrganismos y un compuesto volátil vinculado a un defecto, podría ser meramente un efecto secundario de la aparición previa de otro microrganismo que sería necesario para la actividad del primero, siendo ello causa en muchas ocasiones de la imposibilidad de obtener patrones claros en el que se detecte un único atributo negativo en aceites con defecto/s.
Los principales defectos sensoriales son, de acuerdo con las definiciones en el Anexo XII del Reglamento 2568/91:
- Atrojado-Borras: Flavor característico del aceite obtenido de aceitunas amontonadas o almacenadas en condiciones tales que han sufrido un avanzado grado de fermentación anaerobia o del aceite que ha permanecido en contacto con los lodos de decantación, que, a su vez, han sufrido un proceso de fermentación anaerobia en trujales y depósitos. El defecto de atrojado estaría caracterizado por la presencia de etanol (38%), octano (14%), acetato de etilo (12%) y metanol (11%). Estos compuestos podrán incluso estar 'mezclados' con otros compuestos volátiles vinculados a atributos positivos, aunque ello no implica que no puedan ser percibidos de forma independiente o incluso se generen descriptores diferentes a los identificables de cada compuesto por separado. Sin embargo, la aparición de 'nuevos compuestos' es muy elevada con respecto a los 'normales' de un AOVE, siendo mayor la concentración de volátiles en los aceites con este defecto. Hay que destacar que en aceites con este defecto se detectan un elevado número de ésteres, también identificados en aceites procedente de aceitunas sobremaduras que podrían provenir de las actividades enzimáticas de los citados microrganismos. Estos metabolitos pueden ser vinculados cualita-cuantitativamente con microrganismos presentes en los frutos durante su almacenamiento. Así los compuestos 2- y 3-metil-butan-1-al, sus correspondientes alcoholes y los ácidos propiónico, 2-metil-propanoico y 3-metil butanoico se producen durante el atrojado a partir de los aminoácidos valina, leucina e iso-leucina (Angerosa, 1996), en un inicio, por bacterias del género Aerobacter y Escherichia, mientras que en más largo tiempo serían del género Serratia, Propionibacterium y Clostridium. En menor proporción, Pseudomonas generan aldehídos ramificados, alcoholes ramificados y sus respectivos ácidos (2-metil-propanol, 2-metil-propanal, ácido propiónico, ácido 2-metil-propiónico), superando en poco tiempo el umbral de percepción en la cata. El desarrollo de microrganismos se ve favorecido por el efecto del aplastamiento en la tolva de las aceitunas, el cual, al exceder un determinado volumen y en función de la dureza y madurez de los frutos, tiene lugar el estrujado o incluso la rotura física total de la aceituna. La pulpa de aceituna, su jugo, aceite y nutrientes se convierten en un buen medio de cultivo, sin que la acción tóxica de los fenoles pueda tener efecto para frenar el crecimiento de los microrganismos. Pero a día de hoy, este efecto no es la principal causa de la aparición de defectos, pues el tiempo de demora de procesamiento no es tan elevado como hace 10-20 años. Con las mejoras en la almazara, sobre todo por capacidad de procesamiento, se muestra que todo daño físico que sufre la aceituna, desde la cosecha hasta su transporte, causaría la liberación de material fermentable y generaría así los compuestos volátiles vinculables con este atributo negativo. Quizás con el más rápido procesamiento se ha minimizado las intensidades de los defectos, pero se sigue percibiendo en cata, y es porque desde su recolección hay que hacer todo lo posible por mantener la integridad física de los frutos y evitar la espoliación por parte de los microrganismos de las aceitunas.

- Moho-humedad: Flavor característico del aceite que puede tener dos orígenes, (1) generado a partir de frutos en las que se han desarrollado una alta población de hongos y levaduras a causa de haber permanecido amontonadas con humedad varios días, (2) derivado de las aceitunas que han sido recogidas con tierra o barro y que no han sido lavadas eficientemente. El moho estaría caracterizado por los volátiles etanol (30%), éster butil-fórmico (10-5%), acetato de etilo, 2-butanol, 1-propanol y etilpropionato. En estos aceites desaparece el compuesto trans-2-hexenal (césped recién cortado), y aparecen compuestos de 8 átomos de carbono como el 3-octanol y 1-octen-3-ol (Angerosa, 2002; Morales et al., 2005). La no presencia en el aceite final de 2-hexenal sería indicativo de cómo los enzimas fúngicos interfieren en la ruta de la lipoxigenasa y podría ser un indicador precoz de la aparición de este defecto en futuras herramientas basadas en una nariz electrónica. Para el descriptor 'humedad' el etanol y hexanal representan el 20%, metanol en torno al 12% y entre el 4-10% de propanal, pentanal y propilpropionato. Ningún compuesto domina con más del 20%. Estos defectos podrían estar causados por mohos como Aspergillus parasiticus y Penicillium nalgiovense. Morales et al. (2005) destacan que pueden encontrarse en las aceitunas que generan estos tipos de aceites hongos como Alternaria, Fusarium, Rhizopus o bien hongos del tipo Candida, Pichia y Saccharomyces.
- Avinado-Avinagrado/Ácido-agrio: Flavor característico de algunos aceites que recuerda al vino o vinagre. Es debido fundamentalmente a un proceso fermentativo aerobio de las aceitunas o de los restos de pasta de aceitunas que no han sido limpiados adecuadamente, que da lugar a la formación de ácido acético, acetato de etilo y etanol. Con la generación del etanol por fermentaciones, éste se transforma en acetato de etilo y acético (Angerosa et al., 1996) promoviendo la evolución del 'avinado' al 'avinagrado'. El acético y el acetato de etilo serían responsable del 70% de los volátiles, y en menor medida el etanol y metanol (16% y 5% respectivamente) (Cayuela et al., 2015). En este defecto podría estar implicada bacterias del género Lactobacillus, Acetobacter, Enterobacter o incluso algunas levaduras como se comentará más adelante.
Es importante anotar que en estos tres defectos existen mucha disparidad de concentración de volátiles. Aceites con estos defectos tendrían mayor contenido en compuestos volátiles que un AOVE con frutado en alta intensidad. Esta diferencia en concentración de volátiles, sobre todo, sería más amplia en los defectos de avinado y atrojado, siendo este último el que tendría más concentración, aunque por lo general, serían un tercio de los que podría tener un aceite con el defecto de rancio (Morales et al., 2005). Por tanto, un aceite con muchos volátiles no siempre es indicativo de calidad, sino de una síntesis alejada de la ruta de la lipoxigenasa y por tanto de aromas y sabores no propios de una aceituna sana.
Actividades enzimáticas provocadas por microrganismos y que afectan a las propiedades de los aceites de oliva vírgenes
Los hongos, bacterias y levaduras aislados en los aceites de oliva han mostrado tener diferentes actividades enzimáticas que van a afectar a la calidad sensorial y al contenido en fenoles principalmente. Los microrganismos presentes en la pasta y/o a los aceites pueden presentar las siguientes actividades enzimáticas:
- ß-glucosidasa: esta actividad que pueden presentar muchas levaduras y bacterias. Junto a la peroxidasa, son de las más habituales entre las especies identificadas en aceitunas y aceites de oliva. Esta actividad podría favorecer la pérdida de polaridad de los derivados de la oleuropeína y del ligustrósido, e incluso aumentar la concentración de fenoles en el aceite final (Guerrini et al., 2015) y acrecentar la intensidad de los atributos amargo y picante. Santona et al. (2017) encontraron más levaduras con esta actividad durante la fase de batido que en el aceite final resultante, siendo indicativo que la influencia de esta enzima puede ser más intensa en dicho paso del proceso, aunque no descartable su actividad tras la elaboración del aceite. La especie Pichia sería de las que más actividad tendrían de esta actividad (Romo-Sánchez et al., 2010). Ciafardini y Zullo (2002a) indicaron también una relación de esta enzima con el pardeamiento del color de los aceites.
- Esterasas: actúan sobre las agliconas de la oleuropeína y ligustrósido, hidrolizando las formas dialdehídicas vinculadas con los atributos positivos de amargo y picante respectivamente. Tanto la actividad glucosidasa como esteresa permanecen muy activa en el primer mes tras la elaboración del aceite y mientras está en decantación. A partir del segundo mes puede perder el 50% de su actividad (Ciafardini y Zullo, 2022). Esta actividad estaría relacionada con la presencia de sólidos en suspensión coloidal mientras decanta el aceite.
- Lipoxigenasas: estas enzimas constituyen una familia de enzimas ampliamente distribuidas en el reino vegetal y animal y, aunque poseen una conducta bastante uniforme, las lipoxigenasas de la aceituna no tienen por qué tener la misma especificidad de sustrato ni generar las mismas moléculas volátiles que las lipoxigenasas de la fracción biótica (Sanz et al., 1992). Por tanto, la contaminación microbiana podría alterar la ruta 'natural' de la lipoxigenasa de la aceituna, tergiversando determinados compuestos volátiles y la aparición de determinados descriptores que no serían propios de frutos sanos. Los hongos Penicillium y Fusarium mostraron una elevada excreción de estas enzimas.
- Polifenoloxidasa: enzima oxidativa que podría favorecer la oxidación de fenoles y otras moléculas.
- Peroxidasas: podría favorecer procesos oxidativos en el aceite. Esta actividad afecta negativamente tanto a la salubridad como a las cualidades organolépticas de los aceites de oliva, ya que degradan los compuestos fenólicos. Son varias las investigaciones que (Romo-Sánchez et al., 2010; Guerrini et al., 2015; Santona et al., 2017) que observaron que esta actividad puede ser presentada por muchas levaduras aisladas en los aceites (Barnettozyma califórnica, Yamadazyma terventina, Candida adriática, Candida diddensiae)
- Lipasas: favorece la hidrólisis de ácidos grasos con el consecuente aumento de la acidez de los aceites. La presencia de levaduras con esta actividad, como C. adriática o C. diddensiae, y mohos como Penicillium, no siempre conlleva a aceites con alta acidez (Torres-Vila et al., 2003; Fakas et al., 2010). La actividad de estas enzimas está relacionada con la actividad de agua, con un máximo de actividad cuando el aceite posee en torno a un 0,25%-1% de humedad en función del microrganismo sintetizador de la enzima. Se ha observado que contenidos en fenoles elevados en el aceite (>500 mg/kg) pueden inhibir la actividad lipasa hasta casi 10 veces con respecto a aceites con <100 mg/kg de fenoles (Zullo y Ciafardini, 2022).
- Pectinasas: desarrolladas por levaduras presentes en el fondo de los depósitos, degradan las pectinas, generan metanol que puede formar ésteres metílicos y causan el deterioro sensorial del aceite.
- Celulasas: no muy habitual entre las levaduras y hongos identificados en pasta de aceitunas o aceites de oliva, siendo más frecuente en la aceituna de mesa y su efecto sobre el ablandamiento de los frutos. Aun así, Romo-Sánchez et al. (2010) detectaron que esta actividad enzimática en 38 de las 42 especies de levaduras identificadas en aceitunas, pasta de aceituna y alperujo.
- ß-glucanasa: Esta enzima, como las esteresas, puede hidrolizar los derivados secoiroideos con iguales consecuencias para la calidad oxidativa y sensorial de los aceites (Fancello et al., 2020). Romo-Sánchez et al. (2019) han descrito que cerca de la mitad de las 42 especies de levaduras aisladas tenían esta actividad enzimática.
- Decarboxilasa: es una actividad negativa en cuanto se relaciona con la síntesis de aminas biógenas, compuestos alérgenos que pueden provocar reacciones de inflamación en humanos. Santona et al. (2017) la detectan 9 levaduras de 64 identificadas en aceitunas y aceites, y en 15 de las 19 bacterias aisladas en su estudio.
Otras actividades enzimáticas como Catalasa (descrita en C. adriática, C. diddensiae y Y. terventina por Zullo y Ciafardini, 2020), Protesasa o Poligalacturonasa (Lilao et al., 2015) no son muy activas o afectan de forma relevante durante el proceso de extracción y calidad de los aceites de oliva vírgenes.
'Antracnosis', 'Aceituna Jabonosa', 'Lepra': el devorador del alma de la aceituna
Aunque en el siglo XI se describe una enfermedad que encajaría con los síntomas de la antracnosis, no es hasta finales del siglo XIX cuando se describe por primera vez esta enfermedad en Portugal, siendo Colletotrichum gloesporioides el hongo causante de la enfermedad. A día de hoy se destaca como una de las principales plagas a nivel mundial. Es conocida en España como 'jabonosa', en Italia como 'lebbra' y en Portugal como 'gafa'.
La enfermedad provoca la momificación o caída prematura en su máximo desarrollo. En ataques severos podría incluso provocar la muerte de la rama del olivo. El daño que ocasiona al fruto no es solo visual, sino que incluso antes de detectarse la infección, en una fase de latencia, han tenido lugar daños en el perfil sensorial y fisicoquímico irremediables: defectos sensoriales intensos, aumento notable de la acidez (hasta superiores a 5% en frutos con una alta incidencia), ligero aumento de las ceras y reducción del contenido en fenoles. Todo ello conlleva a importantes pérdidas económicas, pues el ataque del hongo y sus consecuencias son muy difíciles de detectar en los estadios tempranos. En un interesante ensayo, Peres et al. (2021) observaron que, con tan solo 3 días de incubación, se desarrollan defectos sensoriales (tierra y moho) en aceituna Galega y en 8 días en Cobraçosa. También podría ocurrir un cambio en el perfil de ácidos grasos, aunque no por síntesis de nuevos triglicéridos, sino por aporte de los microorganismos. El contenido de fenoles en los aceites resultantes se reduciría notablemente (Peres et al., 2021), influyendo en ello, entre otros factores, el aumento del pH de la pasta de aceituna como se comentará más adelante.

La antracnosis del olivo es causada por al menos 13 especies de Colletotrichum, que pertenecen a los complejos C. acutatum, C. gloeosporioides y C. boninense. Entre las especies pertenecientes al complejo C. acutatum, C. godetiae es dominante en Grecia, Italia, Montenegro y España. C. nymphaeae es la predominante en Potugal y C. acutatum sensu stricto es la prevalente en Túnez. La expansión de determinada especie y aumento de la incidencia va en aumento cada campaña, identificándose especies nuevas, así como la sustitución de predominancia entre diferentes especies. Este último aspecto afecta de forma significativa a España y Portugal pues C. acutatum está siendo el principal agente causante sustituyendo a C. nymphaeae, con una incidencia superior al 97%, pudiendo ocasionar la total pérdida de la producción en olivares susceptibles a este hongo (Iannota et al., 1999; Cacciola et al., 2012; Talhinhas et al., 2018; Gouvinhas et al., 2019; Azevedo-Nogueira et al., 2020; Peres et al., 2021; Gomes et al., 2021; Moral et al., 2021; Romero et al., 2022).
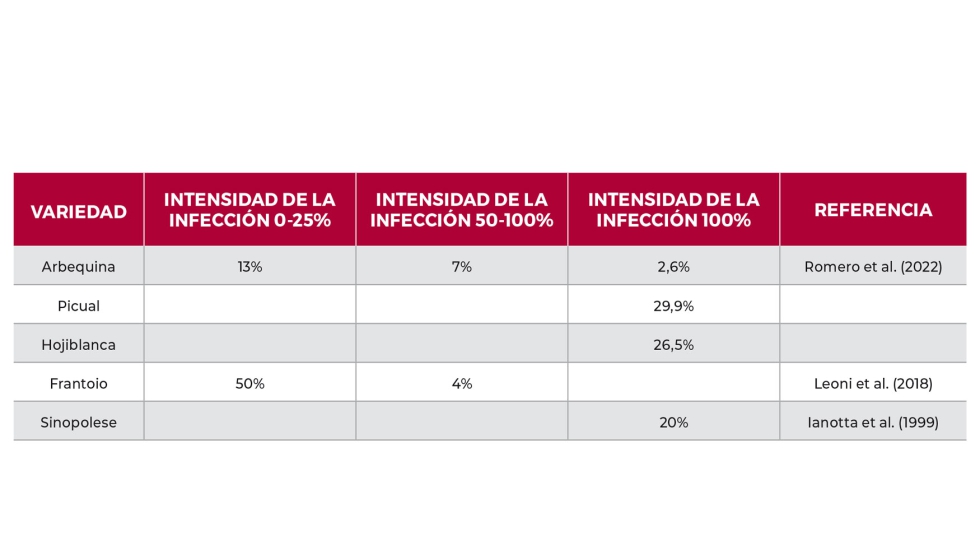
La incidencia de la enfermedad va a depender de cuatro factores:
1. Variedad: Esta mayor o menor resistencia de cada variedad de olivo podría estar influenciada por la concentración de fenoles en la pulpa, el epicarpo del fruto o el estado nutricional de la planta. Es importante diferenciar que la sensibilidad de una variedad a esta enfermedad no implica que el aceite se pueda ver perjudicado en igual intensidad. La variedad Arbequina ha sido descrita como muy sensible a esta enfermedad, pues con tan solo un 2,6% de los frutos afectados al 100%, se perdería la categoría comercial de 'Virgen Extra'. En cambio, para Hojiblanca necesitaría un 30% de los frutos con síntomas y para Picual el 26,5% de los frutos para perder la categoría AOVE (Romero et al., 2022). En otras variedades italianas se observa una incidencia similar a las encontradas para las variedades Españolas (Tabla 1). Con esta diferente sensibilidad e impacto en la calidad del aceite, el perder un poco de aceite por una recolección temprana sería más deseable que la pérdida de la categoría comercial y la calidad total del aceite a obtener, además de suponer un riesgo para el resto de las producciones en la misma almazara.
2. Prácticas culturales: la fertilización, el marco de plantación, la poda, un control químico eficiente (son pocas las materias activas y cada vez menos efectivas), la contaminación cruzada por la mecanización del olivar, etc., afectarán al desarrollo y propagación de la enfermedad. La mejor forma de evitar graves daños económicos por la enfermedad pasaría por fomentar la recolección temprana.
3. Estado de madurez: el ciclo de la enfermedad comienza con la infección de inflorescencias y frutos en desarrollo a través de conidias durante la primavera-verano (Romero et al., 2022). Las infecciones en los frutos en desarrollo permanecen latentes hasta las lluvias otoñales y reducción de la temperatura, la cual suele tener lugar con los frutos maduros. No obstante, en frutos 'tempranos' el hongo está en latencia y podría ya provocar ligeros efectos negativos en los parámetros fisicoquímicos, aunque no consecuentemente la pérdida de la categoría comercial.
4. La especie de Colletotrichum: Peres et al. (2021) observaron como más virulenta la especie C. nymphaeae para Galega y Cobraçosa, mientras que C. Godetiae fue menos virulenta para Cobrançosa frente a Galega. La identificación de la especie es compleja pues realmente tanto C. acutatum como C gloeosporioides y C. boninnse son considerados un mismo 'complejo' de varias especies, concretamente de 6, 2 y 3 especies respectivamente.
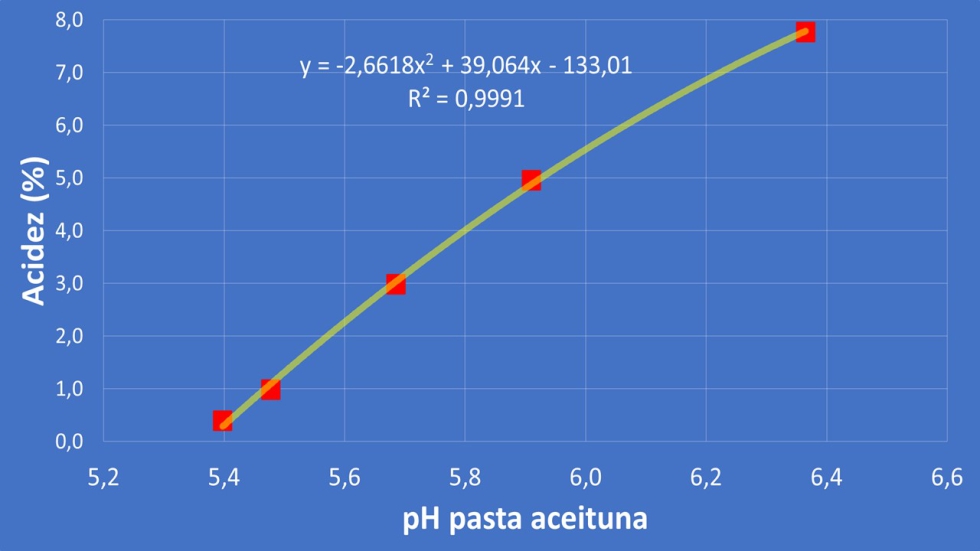
Esta enfermedad está afectando en gran intensidad a olivar en marco superintensivo de Portugal y Extremadura, 'explotando' el problema en la almazara cuando se obtienen aceites de alta acidez ante la dificultad de la detección en la recolección por equipos cabalgantes, hecho agravado por lo comentado anteriormente, solo una afección de un 3% de la producción provoca en algunas variedades la pérdida de la categoría comercial. Para poder identificar potenciales problemas se puede emplear un sistema fácil y económico en las almazaras. Como se muestra en la Figura 1, con una simple medida de pH se puede identificar lotes que van a generar aceites de alta acidez. El pH de la aceituna arbequina suele estar en torno a valores de 5,0-5,2 (más bajo en estado tempranos y mayores a final de campaña); otras variedades de aceitunas, sanas, poseen pH inferiores, en torno a 4,7-4,9. Valores por encima de 5,4 ya sería indicativo de crecimiento de microrganismos y, por ende, riesgo de deterioro de la calidad seguro. Por tanto, una simple medida del pH de la pasta de aceituna triturada serviría para evitar graves problemas en la bodega.
Microbiología epifita en la aceituna: efecto de la recolección y postcosecha
La fracción oleosa de las aceitunas en el fruto intacto está libre de microorganismos antes de la recolección, sin embargo, en el epicarpo se pueden encontrar un grandísimo número de mohos, levaduras y bacterias (Romo-Sánchez et al., 2010) que, sin lugar a duda, serán una combinación de los microrganismos característicos del suelo, endémicos de la zona, de plagas y enfermedades que afecten al olivo o a otro cultivo.
Sin embargo, durante el proceso de extracción los microrganismos colonizan la fracción oleosa provenientes de diferentes fuentes, no solo la población epifita en el fruto, sino incluso la 'oportunista' inoculada en los pasos de recepción (tolvas, limpiadora, lavadora, cintas…) y extracción del aceite (máquinas, bombas, tuberías, sinfines...).
Desde la recolección del fruto, cómo se haga y el daño físico que rompe la integridad del fruto, favorece el desarrollo y crecimiento de numerosos microrganismos, así como de aparición o incremento de concentración de sus metabolitos, negativos para la calidad de los aceites.
Influencia del sistema de recolección
Hay varios factores que podrían influir en la estructura y composición de las comunidades microbianas del olivo, como por ejemplo, la recolección, la manipulación, el transporte y el almacenamiento. Por lo tanto, es difícil determinar de forma inequívoca qué factor específico o combinación de factores fue el responsable de la divergencia entre las comunidades bacterianas de diferentes cultivares de aceitunas.
Las aceitunas cuando llegan a la almazara poseen una importante carga de microrganismos, propios de los frutos, más los inoculados por el polvo o resto de tierra y los que se desarrollen favorecidos por la humedad natural de las aceitunas o por la pérdida integral de la aceituna. Gran parte de estos microrganismos se encuentran fácilmente en el suelo, llegando por el polvo del campo o por los medios de recolección y transporte al epicarpo. Las aceitunas serían el principal vehículo de llegada de los microrganismos a la almazara, y por ello hay que prestar atención al resto de los pasos del proceso que, no solo podrán eliminar o favorecer el crecimiento de su número, sino incluso 'aportar' su biota autóctona.
Estudios previos han mostrado cómo en el olivo, diferentes variedades de aceitunas, en diferentes ecosistemas, poseen una variabilidad elevada, más cualitativa que cuantitativa de microrganismos, desde Pseudomonas sp. en olivos con fuerte ataque de tuberculosis hasta una alta cantidad de bacterias que perecerán en el batido. Pero todas dejarán su sello en la calidad final del aceite.
La limpiadora-lavadora como foco de contaminación microbiológica
Los trabajos revisados para la redacción de este trabajo muestran que en todos los pasos del proceso existen riesgos y se pueden establecer medidas preventivas que maximicen la calidad de la aceituna recepcionada. En esta línea, la limpieza y lavado de los frutos son pieza clave, no solo para no inocular microorganismos, sino incluso rebajar parcialmente la microbiota epifita en las aceitunas.
Zullo y Ciafardini (2022) recomiendan la eliminación de todo el material vegetal que acompaña a la aceituna, ramas y hojas, pues incluso parte de éstas vienen enfermas y sería foco de muchos microrganismos. Aun así, el trabajo de Romero (2011) constató que el nivel inicial de contaminación aumenta significativamente en las diferentes operaciones en el patio de recepción de la almazara, sobre todo tras el lavado de la aceituna.
El lavado puede ser un importante punto en el que se podría eliminar parte de la carga de microrganismos del epicarpo. Sin embargo, la problemática real indicaría que más bien la lavadora podría convertirse en un foco de contaminación cruzada más que en un sistema de reducción.

De acuerdo con la legislación y normas del Consejo Oleícola Internacional, el agua de la lavadora debe ser agua potable y, por tanto, libre de presencia de microorganismos por el cloro libre que contiene. Sin embargo, desde el primer lote de aceituna lavado, este 'agua' se carga de solidos en suspensión, materia orgánica, pesticidas, aceite, jugo de la aceituna y microrganismos. Estos últimos encuentran un medio en el que se podrán desarrollar y crecer (Montaño, 2019). En la lavadora se van a detectar bacterias, hongos y levaduras, en diferentes órdenes de magnitud que pueden ir desde 0 hasta 9. Generalmente las bacterias, a diferencia de en las siguientes fases del proceso, van a ser la mayoritarias frente a levaduras y mohos (Vichi et al., 2011; Ciafardini et al., 2017). El lavado en sí no es tan perjudicial para la calidad como el hecho de contaminar las aceitunas, de facilitar la inoculación cruzada y de promover las actividades biológicas de levaduras, bacterias y mohos.
En esta agua de la lavadora podremos encontrar una amplia gama de microrganismos, y aunque no todos van a aparecer en el aceite final, sí van a ser críticos, porque sus metabolitos y enzimas van a marcar la calidad del aceite, actuando desde el mismo momento que entra la aceituna en la lavadora hasta que la pasta de la aceituna entra en el molino. En todo ese tiempo, se va a producir un daño sensorial y químico crucial. Quizás este impacto no sea lo suficiente para perder la categoría comercial, pero sí para provocar con seguridad:
- Un decremento de la intensidad de frutado: perjudica porque un frutado intenso (f≥6) pasaría a ser frutado medio (3<f<6), con la consecuente pérdida de valor de la calidad.
- Pérdida de intensidad de descriptores 'verdes' (baja p.e. el compuesto 1-penten-ona) y se incrementan las notas 'frutas maduras' (banana, fresa, kiwi). Esto se debe a 'interferencias' en la ruta de la lipoxigenasa, posiblemente por la maquinaria enzimática de los microrganismos, así como competencia por los sustratos de esta ruta. A nivel químico se ha demostrado una reducción de los aldehídos de 5 y 6 átomos de carbono (C5 y C6), aumentando los alcoholes y acetatos. Angerosa (2002) encuentra una relación directa (r=0,990) entre el grado de infección de la aceituna con la ratio de hexanal con el total de alcoholes.
- Reducción de la intensidad del amargor, picor y astringencia. Las actividades enzimáticas de los microrganismos favorecerán una reducción de los Derivados Secoiroideos (formas aldehídicas y dialdehídicas de la aglicona de la oleuropeína, relacionadas con el amargor y la astringencia de los aceites). Incluso determinarán más el contenido final en el aceite que las variables tiempo de batido (relación inversa con el contenido final de fenoles) y la temperatura (relación directa con el contenido final de fenoles) (Zullo et al., 2014; Vichi et al., 2015).
- Generación de volátiles negativos, por la acción prolongada de la actividad enzimática de los microrganismos. Vichi et al. (2011) observaron que el agua de lavado con alta carga de microrganismos aporta a los aceites resultantes de volátiles negativos, como etanol, acetato de isoamilo, bencen-metanol, bencen-etanol, 3- y 2-metilbutanol y metil-butil-acetato.
- También se provoca una pérdida de 'color', aumentando los pardos por oxidación de las clorofilas, las cuales, además, pueden ver disminuida su concentración (Romero, 2011). Vichi y colaboradores (2011 y 2015) incluso determinaron que el impacto de los microrganismos en la contracción de clorofilas en el aceite final sería más influyente que las tradicionales variables de tiempo y temperatura de batido. Los pigmentos carotenoides, como las xantofilas, ser varían menos afectados por los microrganismos.
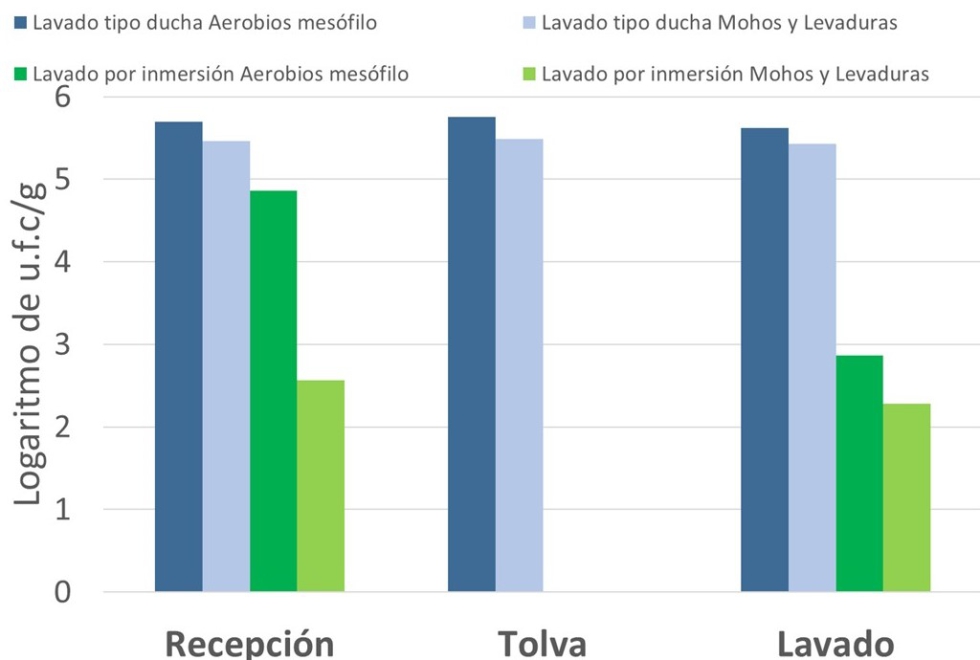
Fuera aparte de este problema que deberá ser solucionado, es importante anotar que no tiene el mismo efecto lavar por inmersión que 'dar una ducha a las aceitunas'. Los resultados de investigaciones realizadas por CTAEX indican que solo una inmersión en agua limpia se puede rebajar la carga microbiana de orden 4 a orden 2 (Figura 2). En cambio, una ducha sin inmersión en agua mantendría la carga microbiana y solo tendría la finalidad de eliminar impurezas de polvo o restos del agua de la lavadora adsorbida a la aceituna. En estos ensayos no hubo una demora o reposo en tolvas que favoreciera un crecimiento de los microrganismos.
Conservación en tolvas: polvorín metabólico de la maquinaria enzimática de la aceituna
Tras la recepción de los frutos, de forma habitual, son conservados en tolvas hasta su procesamiento, una demora que si es larga se denomina atroje, aunque generalmente es inferior a 24 horas, y se le considera una 'demora en el procesado'. Durante este periodo ocurren tres hechos:
- Hay un daño sobre el fruto, físico por rotura interna del tejido del mesocarpo y/o por influencia de la maquinaria enzimática de los microrganismos, y con ello, una disminución de los volátiles y de los que se vinculan a atributos 'verdes' como se ha comentado anteriormente.
- Un ablandamiento de los frutos, lo que conllevará a un incremento en los frutos rotos, bien físicamente por el peso, o bien rotura por las enzimas de los microrganismos.
- Incremento de los microrganismos oportunistas, que aprovecharán el “medio de cultivo” liberado para multiplicarse y generar sus metabolitos de descomposición por fermentaciones.

La demora del procesado provoca una pérdida de intensidad aromática por la reducción de la concentración de compuestos como trans-2-hexenal o cis-3-henenol-acetato, relacionado con los descriptores de césped recién cortado y verde, entre otros (Angerosa et al., 1996). Al mismo tiempo, tiene lugar un incremento de otros compuestos relacionados con los microrganismos, los que provocan, primero una distorsión del flavor, y en segundo lugar, la generación del defecto. Esta evolución tiene lugar por un incremento cualitativo y cuantitativo de microrganismos. En la aceituna, como se ha comentado previamente, pueden detectarse poblaciones de orden 2-3 hongos, bacterias lácticas y Pseudomonas sp. Pero se observa que en poco tiempo aparecen nuevas especies, como bacterias acéticas, enterobacterias y Clostridium sp., que pueden incrementar hasta una concentración de orden 5. Este proceso se acelera con la maduración de los frutos (posiblemente por la reducción de dureza de las aceitunas), pérdida de la integridad física por el maltrato al fruto en recolección postcosecha y por el lavado ineficaz.
En esta línea es importante anotar que, en el caso de las aceitunas atacadas por mosca (Bactrocera oleae), el daño causado por las larvas de mosca es mayor que la simple presencia del gusano, pues facilita la colonización y desarrollo de una variada microflora saprófita que origina podredumbres y fermentaciones de los frutos (Torres-Vila et al., 2003). Una vez que los agujeros de emergencia posibilitan la entrada de aire al interior del fruto, los requerimientos para el desarrollo de la microflora saprófita son óptimos en la pulpa dañada por la larva de mosca. Torres-Vila y colaboradores (2003) observaron que, en las muestras de aceitunas picada por mosca en la zona de Vegas Bajas en Badajoz, las bacterias del género Xanthomonas eran el principal microrganismo, bacterias con actividad lipasas y celulósica. La acidez del aceite es un reflejo del daño físico causado, el cual se ve aumentado con el tiempo hasta la molturación de la aceituna (demora en el procesado sin necesidad de atroje en la tolva). En este trabajo también se anota el importante efecto que otros factores como la parcela y el mes de recolección (tiempo que actúa la infección sobre el mesocarpo) puede tener sobre la microflora y la acidez final del aceite.
Antes se ha anotado el hecho de dejar 'reposar' aceitunas un corto periodo (12-24 horas), sobre todo porque las entradas de 400-800 t en cuestión de 4-6 horas en una gran almazara obliga a una demora en el procesado. No obstante, es frecuente justificarlo para que la aceituna 'se rinda', pierda agua (tanto de la adsorbida en el lavado, como la vegetal), pero inconscientemente se favorece el desarrollo de bacterias, como las del género Enterobacter, que tiene en su maquinaria enzimas pectiolíticas que degradan la pared celular y de la cutícula (epicarpo), lo que lleva a un ablandamiento de las células de la aceituna y un mayor riesgo para la integridad física. A ello se suma la actividad celulósica de las bacterias del género Clostridium. Es interesante anotar un resultado obtenido por Vichi et al. (2015) en el que, comparando el rendimiento industrial de aceitunas arbequinas no-lavadas, tras el lavado, y tras lavar y conservar durante 12 horas, no se obtuvo una diferencia significativa en la extractabilidad por Abencor (53,3-55,3%), por lo que no necesariamente dejar 'que se rindan' las aceitunas garantizaría a una mejora de rendimiento industrial si no interfiere el agua adsorbida tras el lavado.

Finalmente, aparecerán los organismos oportunistas, como las Lactobacillus sp. y levaduras, fermentan azúcares, y generan etanol. A estas les siguen las bacterias Acetobacter sp. que oxidan el etanol a acetato de etilo y luego a acético. También los aminoácidos son sustrato de procesos metabólicos que generarán volátiles negativos como se ha anotado anteriormente.
En la región de la Provenza, en Francia, esta práctica de conservación y promover las fermentaciones se ha convertido incluso en un 'arte', al identificarse ese desarrollo de microrganismos como 'Frutado Negro'. En este sistema de elaboración se conservan las aceitunas en un lugar cálido provocando aromas a 'trufa' y un dulzor en ausencia de picor y amargor. Es decir, se describe la generación de un defecto de moho. Incluso se intentó proteger mediante una DOP, fracasando al provocarse con ese sistema tradicional de elaboración, un defecto sensorial que impedía calificar al producto como 'Virgen Extra'.
En este apartado es importante indicar que, los sistemas que en los últimos años se están instalando en algunas almazaras de refrigerar las aceitunas podrían ser importante para 'frenar' o limitar estos daños, sobre todo los ocasionados o relacionados con los microrganismos. Esta funcionalidad podría tener una utilidad a lo largo de toda la campaña, no solo en la recolección para aceites verdes o tempranos. No existen trabajos entre la bibliografía consultada, al menos hasta la fecha de redacción de este artículo, que directamente demuestren este hecho, aunque las mejoras que ofrecerían la refrigeración de la aceituna, así como de la pasta, vendría a reducir los daños de pérdida de intensidades y de volátiles que en los apartados anteriores se han ido anotando como provocado por la presencia de microrganismos (pérdida de volátiles verdes, aumento de los maduros, pérdida amargor…) (Dourou et al., 2019; Guerrini et al., 2021).
Microbiología en el proceso de extracción de los aceites de oliva vírgenes
Aunque los microrganismos han sido utilizados desde tiempos antiguos para la producción de determinados y particulares alimentos, por su capacidad de usar diferentes sustratos para desarrollarse (queso, leche, aceituna de mesa…), esta capacidad puede tener un efecto negativo en cuanto a que pueden degradar un producto que es 'útil' o válido para el consumidor. Los microrganismos pueden desarrollar un amplio rango de productos químicos que alteran los atributos de calidad de muchos alimentos. En este sentido, los alimentos bajo una inadecuada conservación pueden sufrir una degradación y generar un alimento de menor calidad, como ocurren en las aceitunas que potencialmente pueden dar un AOVE.
Es importante anotar que los estudios sobre la presencia de microrganismos en lo aceites están aumentando en los últimos 4 años, aún queda mucho por conocer y sobre todo por explicar la gran variabilidad en resultados a partir de diferentes variedad y almazaras.
Los hongos y las levaduras son los microrganismos predominantes en todos los pasos de extracción, siendo bastante más baja la presencia de bacterias. Los datos de unidades formadoras de colonias (u.f.c.) es bastante variable en función del estudio, pudiendo encontrarse rangos de levaduras-hongos entre 10 a 104 u.f.c./g (entre orden 1 y orden 4) en la pasta de la aceituna recién molida (Guerrini et al., 2015). Algunos microrganismos podrían incluso sobrevivir al paso de molienda y batido, sobreviviendo en las microgotas de agua en suspensión coloidal del aceite (Guerrini et al., 2015).
Los hongos, aparecen en la aceituna preferentemente derivados por alguna enfermedad presente en el olivo. El término 'hongo' se utiliza en sentido amplio para designar los hongos que no son levaduras. El más frecuente en los aceites es del género Aspergillus. En el proceso de extracción, de forma general, decrementan su presencia conforme se ejecutan los pasos de la extracción del aceite, hasta llegar a estar generalmente ausentes en el aceite filtrado final. La concentración de hongos en el aceite final sin filtrar está directamente relacionada con la concentración inicial presente en la aceituna (r=0,7347) (Guerrini et al., 2015). No obstante, su supervivencia en los aceites de oliva vírgenes es baja porque suelen morir durante el almacenamiento, aunque de forma puntual han sido identificado otros tras 6 meses de conservación (Zullo et al., 2020 a y b).
Por otro lado, las levaduras presentan un comportamiento más variable que los hongos, sin una clara tendencia a reducir su concentración con forme se desarrolla los pasos de elaboración. Zullo y Ciafardini (2022) cifran en 25 especies las aisladas por ellos a partir de muestras de aceites de oliva vírgenes de seis países (Italia, España, Eslovenia, Croacia, Israel y Portugal), de las que ocho han sido nuevas especies.
Las levaduras, en principio de campaña, podrían reducirse en uno o dos órdenes de magnitud entre el batido y su presencia en el mosto oleoso, mientras que, con frutos maduros de final de campaña, incluso podrían aumentar en otros dos órdenes de magnitud, mostrando un crecimiento entre la batidora y/o el decanter, y sin relación con el contenido inicial en las aceitunas procesadas. Estas levaduras se pueden detectar en la batidora, en el mosto oleoso y hasta después del filtrado en aceite envasado seis meses antes. Dos estudios, uno de Alonso-García et al. (2019) y otro de Zullo y Ciafardini (2019) mostraron la importancia de la pre-adaptación en cepas de Lactobacillus pentosus para la activación de genes y del recubrimiento con aceite sobre diferentes cepas de levaduras como mecanismos para incrementan la implantación en matrices grasas. La persistencia de suciedad con la campaña podría favorecer esta mayor adaptación y, por ende, presencia en el aceite final con el desarrollo de la campaña. Por tanto, las buenas prácticas de elaboración y de higienización deben ser mantenidas durante todo el desarrollo de la campaña, más aún cuando más riesgo de contaminaciones pueden tener lugar.
Las bacterias se han cuantificado en una baja concentración en las aceitunas, sus pastas y casi escasa presencia en el aceite final. La mayoría de las bacterias sucumbirían a la acción tóxica de los fenoles liberados tras la molienda de la aceituna. No obstante, sus consecuencias y perjuicio a la calidad pueden quedar marcadas desde los daños en postcosecha. La presencia de bacterias en los aceites de oliva vírgenes puede ser peligrosa para la calidad del aceite comercial, debido al potencial aumento de la acidez libre, de los peróxidos y de los valores espectrofotométricos y, sobre todo, por la formación de volátiles que conduzcan a defectos sensoriales.
Santona et al. (2018) y Pizzolante et al. (2018) identifica un alto número de bacterias, algunas de ellas encontradas en los frutos y en el aceite final, mientras otras, serían identificadas en las aguas de las lavadoras o en algunos de los reservorios de la almazara. Las bacterias encontradas en el aceite pertenecían a los géneros Serratia sp. y Staphylococcus sp. También se encontró bacterias del género Serratia en los frutos de las aceitunas, por lo que éstas podrían considerarse como reservorio de esta especie bacteriana.
Guerrini y colaboradores (2019) monitorizaron el contenido de levaduras en los diferentes puntos del proceso de extracción de aceite a lo largo de la campaña. Obtuvieron que, mientras en la aceituna de entrada la población contabilizada estaba en un orden 2-3, tiende a aumentar conforme la aceituna es molida, en el batido, en el mosto oleoso, y finalmente, en el orujo. Destacaron que aún es mayor el aumento conforme avanza la campaña, es decir, con la misma carga inicial, en el mosto oleoso llega a una concentración de orden 4 en el batido. Es decir, a lo largo de la campaña y en cada paso del proceso tiene lugar una colonización, se generan focos de contaminación, que deberán ser erradicados o minimizados mediante limpieza e higiene para no influir en la calidad final del producto.
Aun así, se han descrito presencia de bacterias en el aceite final del proceso: Francello et al. (2020) aislaron hasta 51 especies diferentes en 15 aceites monovarietales diferentes obtenidos a nivel piloto. Esta supervivencia puede venir por la propiedad de algunas especies, como P. séptica por producir carotenoides y bioemulsificantes que capacitan al microrganismo a sobrevivir en un medio tan inhóspito.
Molienda
Sin embargo, con la a liberación de compuestos como los fenoles, se provoca la muerte de un alto número de especies de microorganismos, sobre todo bacterias, aunque algunas levaduras, sobre todo, sobreviven hasta llegar al aceite final conservado en los depósitos (Ciafardini et al., 2017). La biodiversidad de levaduras y hongos se ve mermada tras la molienda.
Guerrini et al., (2019) observaron que hasta mediado de campaña, tras la molienda tiene lugar una reducción de la cantidad de levaduras en la pasta de aceituna en torno a un orden de magnitud, mientras que a final de campaña, podría tener un importante aumento de un orden sin que, de acuerdo a este trabajo, se deba a una mayor cantidad de levaduras presente en los frutos, sino más bien, por contaminación entre el lavado del fruto y la salida de la pasta del molino, como por ejemplo, por los puntos de difícil acceso en el masero, sinfines y demás elementos con los que la pasta contacta hasta llegar a la batidora.

Romo-Sánchez et al. (2010) identificaron los microrganismos presentes en la pasta de aceitunas Arbequina y Cornicabra de almazaras de Castilla la Mancha, detectando levaduras diferentes a la que otros investigadores han encontrado en diferentes localidades de Italia (Santona et al., 2017; Santona et al., 2018). Todas las variedades descritas por Romo et al. (2010) pueden provocar fermentaciones en diferentes grados. Pichia holstii y Zygosaccharomyces fermentati fueron la más comunes, habiendo sigo encontradas también en aguas residuales de almazara tanto en Italia como en España (Romo et al., 2010). La biodiversidad de los microrganismos depende de las almazaras (Romo-Sánchez et al., 2010), incluso molturando variedades diferentes también determinará la flora identificada en la pasta durante el proceso de extracción (Santona et al., 2018; Pizzolante et al., 2018; Fancello et al., 2020).
Los microrganismos identificados en el fruto suelen ser característicos del nicho ecológico, tales como Cryotococcus spp y Serratia spp., mientras en los aceites abundan las levaduras como Candida spp o Saccharomyces spp.
Batido
No obstante, las levaduras pueden sobrevivir e incluso aumentar su concentración (Guerrini et al., 2019), hecho constatado, sobre todo a partir de mitad de la campaña, pudiendo aumentar entre 10 y 100 veces desde la lavadora hasta la batidora favorecidas por su desarrollo en un entorno de unos 30°C.
Esto se vería aún más acrecentado con la mala práctica, ya erradicada en las almazaras concienciadas en la calidad, de dejar de un día a otro las batidoras medio llenas con la falsa creencia de 'ahorrar' (solo se ahorra en actitud y buenas prácticas higiénicas). Al igual que arranca a fermentar un vino o una masa de pan, una masa de aceitunas con un inóculo mínimo de levaduras generará compuestos volátiles suficientes como para tergiversar el frutado de aceituna e incluso generar una concentración de volátiles que rebaje la categoría comercial del aceite final.
Separación sólido-sólido y sólido-líquido
Breschi et al. (2022) relacionan la carga de humedad e impurezas con la carga microbiana final de los aceites extraídos. Por ello recomiendan emplear un nefelómetro para evaluar la carga de agua e impurezas insolubles, junto también determinar la actividad de agua y la contaminación microbiana. Incluso marcan un valor de 100-200 NTU como los óptimos al encontrarse estos aceites con unos contenidos de contenido en agua de los aceites entre 0,15-0,20%. Alcanzar estos valores permitiría incrementar la seguridad y estabilidad fisicoquímica del aceite elaborado.
La presencia de levaduras, tanto en la pasta de aceituna durante el batido como en el mosto oleoso tras el decantar, se correlaciona inversamente con la concentración de determinados compuestos volátiles relacionados con atributos positivos, así como directamente con otros relacionados con defectos sensoriales. Así, elevados contenido de levaduras favorecerían la reducción de compuestos volátiles como cis-3-hexenal, trans-2-hexenil acetato y cis-3-hexenil acetato, mientras se relacionaría directamente con la aparición de trans-2-decenal (relacionado con el olor a 'pintura', 'grasa'), metil-acetato (relacionado con el avinagrado), isobutanol o metil-butanol (relacionados con el avinagrado y moho) (Guerrini et al., 2019). El 'daño' o impacto ocasionado por una elevada población de levaduras ya en la batidora 'marcará' el perfil sensorial que se va a obtener tras el decanter. Similares resultados obtuvieron García Mesa y García-Ortiz (2017), y publicados en un número anterior en esta revista (García-Mesa, 2018), quienes observaron que el defecto de arrastre aparece tan solo con la ausencia de limpieza de un día a otro, y, aunque no se pare la producción, la ausencia de limpieza provoca un 'ruido de fondo' perceptible y que lleva al aceite, como mínimo, a la categoría virgen.
Como indica García-Mesa (2018), una línea de elaboración de aceite “no es una tubería en la que no se produzcan depósitos de material durante un funcionamiento en continuo, sino que hay numerosas superficies, recipientes parcialmente llenos, zonas muertas, recovecos, codos, zonas inaccesibles, zonas bajas sin purga, etc., de difícil acceso y limpieza, que servirán como focos de crecimiento de microrganismos y que van a afectar negativamente a la calidad de los aceites”. Demostración de esto es que diferentes autores que analizan la diversidad de microrganismos en diferentes puntos de procesos, coinciden que la mayor cantidad y variedad se localiza en los orujos finales (Romo-Sánchez et al., 2010).
Como resumen o idea básica de este apartado se debe tener claro que un elevado contenido en levaduras en el proceso de extracción, va a generar una peor calidad sensorial al promoverse volátiles relacionados con el agrio, avinado, atrojado y moho. Y no solo existe una relación cuantitativa con las levaduras, sino también cualitativa, pues determinadas levaduras poseen diferentes capacidades metabólicas y de resistencia el entorno en el que están presente.
Microbiología de los aceites: evolución en la conservación, efecto del filtrado y presencia en el aceite envasado
Los aceites de oliva son un medio desfavorable no solo para el desarrollo de microrganismos, sino incluso para su supervivencia, sin embargo, tras la elaboración, éste contiene una cantidad de agua y sólidos en suspensión coloidal, al igual que microrganismos (Montaño y Redondo, 2021). El tiempo de decantación podrá ir rebajando esta humedad y sólidos favoreciendo su decantación. En todo ese tiempo, bacterias y sobre todo levaduras, mantienen su capacidad metabólica y pueden dañar la calidad del aceite.
En un artículo anterior se abordó el tema del filtrado, anotándose que no hay un tipo de turbidez, sino más bien diferentes 'turbideces', pues un aceite velado puede ser caracterizado por un amplio espectro de combinaciones de agua y partículas sólidas (Montaño y Redondo, 2021). En un aceite velado existirá al mismo tiempo partículas muy grandes y pequeñas que van a estar influenciadas por fuerzas electroestáticas y por el efecto estérico de todas en conjunto (Cayuela y Caballero, 2019).

En un aceite velado los microrganismos pueden encontrarse en el aceite:
- adsorbidas a las partículas sólidas,
- en las pequeñas gotas de agua de vegetación. El tamaño de estas gotas varía de 1-5 µm, poseen un bajo pH, entre 5,0-5,5. Estas pequeñas gotas tienen un contenido de nutrientes mínimo y dotan de un espacio para la supervivencia de los microrganismos, aunque, generalmente, no para su desarrollo.
- solubilizados en el propio aceite: Zullo y Ceafardini (2019) analizaron la hidrofobicidad de una batería de levaduras identificadas en aceites de oliva, observando que Candida adriatica y Yamadazyma terventina poseían una hidrofobicidad elevada.
En un aceite recién elaborado se pueden detectar bacterias, que suelen morir en el primer mes en función de la concentración de fenoles, levaduras, que podrán variar cuantitativa (por decantación y muerte) y cualitativamente (algunas especies van a sobrevivir más meses que otras, como por ejemplo C. adriática o Nakazawaea molendinolei (Ciafardini y Zullo, 2022).
Tras la extracción del aceite es habitual la purga de sus fondos y borras, así como realizar trasiegos para evitar el contacto de éstas con el aceite. Este material depositado en el fondo se conforma como un medio rico en agua y nutrientes que suponen un riesgo para el desarrollo de levaduras principalmente. En estas borras se han encontrado una gran variedad de microrganismos, como por ejemplo de género de Brettanomyces o Saccharomyces cerevisiae (vinculada a procesos fermentativos), levaduras pectiolíticas, metilotróficas e incluso productoras de acético (B. acidodurans identificada en las borras de depósitos) (Zullo y Ciafardini 2022). Gran parte de estas levaduras provienen de la decantación de sólidos y el agua en suspensión coloidal a lo largo del tiempo.
Ciafardini y Zullo (2002a y 2002b) siguieron la evolución de la fracción biótica en dos muestras sin filtrar y una muestra de aceite comercial a intervalos de 15 días durante 90 días, muestreando tanto la parte superior como la inferior del aceite almacenado. Los recuentos iniciales de bacterias lácticas y levaduras variaron desde el límite de detección hasta cantidades de orden 3, observándose que las bacterias aeróbicas disminuyeron en la mayoría de las muestras de la porción superior y se mantuvieron sin cambios en las muestras de la porción inferior de cada botella. Con la excepción de las bacterias del ácido láctico en la parte inferior de una muestra turbia, los recuentos no aumentaron. Los recuentos de levaduras también fueron mayores en la parte inferior que en la superior, pero se mantuvieron por debajo de las los tres órdenes de magnitud. Las levaduras y las bacterias lácticas disminuyeron hasta niveles no detectables a los 60 días en la porción superior, pero siguieron detectándose durante 90 días (final del estudio) en la porción inferior. Las levaduras identificadas fueron Candida guillermondii, C. parapsilosis, C. lusitaniae, C. famata, C. albicans y Rhodotorula mucilaginosa. Durante el almacenamiento, los recuentos de moho aumentaron ligeramente a concentraciones de orden uno a orden 1,5. Los mohos identificados pertenecían a los géneros Helicosporium, Alternaria, Penicillium y Aspergillus.
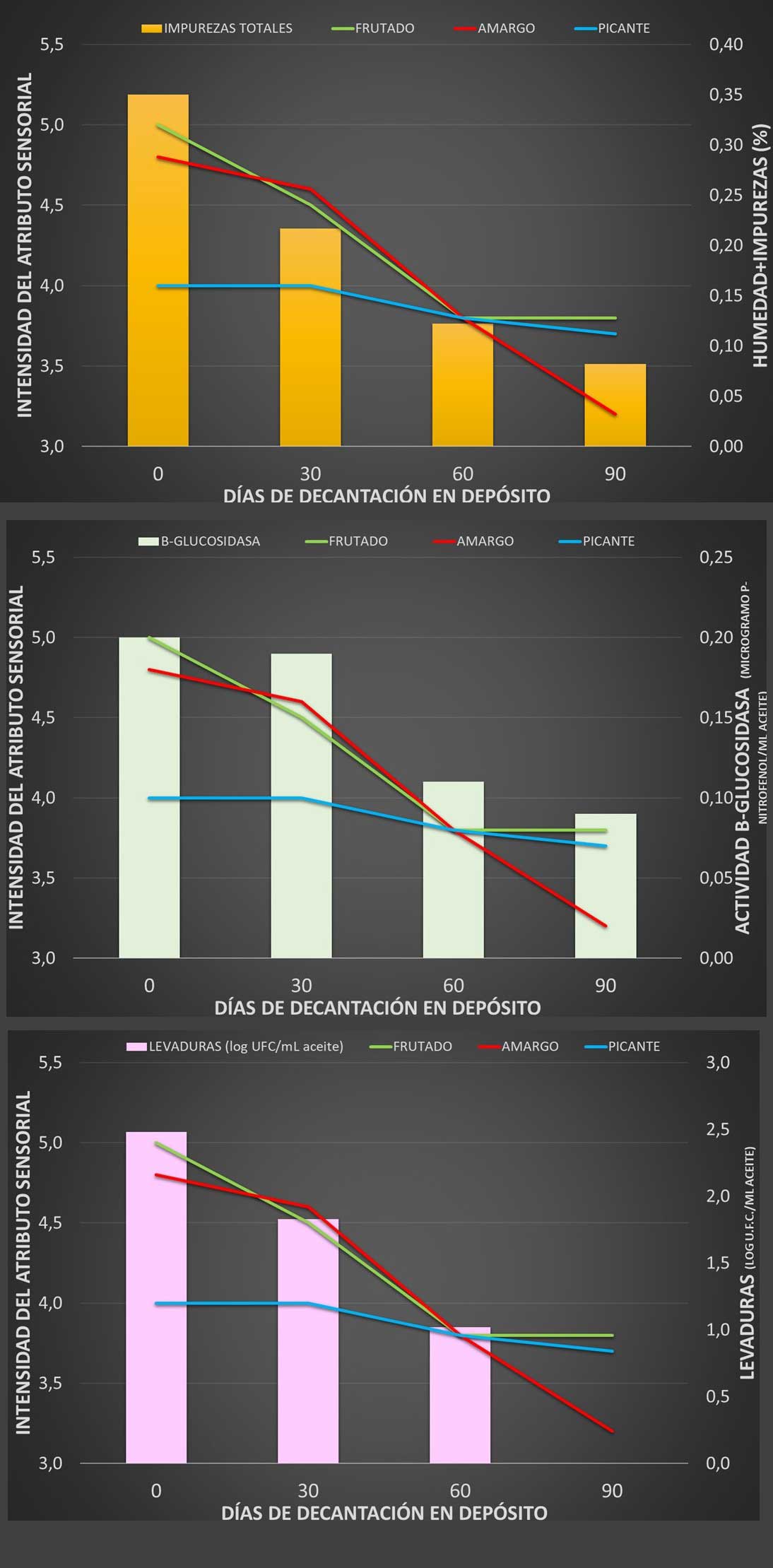
La eliminación de estas impurezas, no solo con la purga frecuente de los depósitos, sin incluso con un filtrado, sin duda, será una solución para eliminar total o reducir la presencia de microrganismos en el aceite (sobre todo los de bajo contenido en fenoles), debiendo seguir siendo conscientes de que la concentración en microrganismos puede ser restaurada parcial o totalmente con el paso de tiempo. En un ensayo en el que se inoculaban diferentes levaduras al mismo AOVE filtrado mostraron que, durante la conservación puede tener lugar incluso una reducción de la población (Guerrini et al., 2019), y aunque algunas cepas no modificaban la categoría comercial del aceite inicial, otras sí provocaron una pérdida de intensidad de atributos positivos frutado (reducción de 4 a 2,5-1,5), amargo y picante; además, pudieron desarrollar defectos sensoriales negativos, como 'borras' y/o 'rancio' (Zullo et al., 2013; Guerrini et al., 2019; Zullo et al., 2020b). Las muestras de aceite con defectos mostraron un mayor contenido en trans-2heptanal, 6-metil-5-hepten-2-ona y 2-octanona, junto con una reducción de volátiles C6 relacionados con los atributos positivos (Zullo et al., 2020b). Guerrini et al. (2019) recogen incluso que, en un ensayo de conservación de aceite envasado e inoculados con determinadas levaduras, se provocaba además de lo anteriormente comentado, un deterioro fisicoquímico del aceite (aumento acidez y peróxidos, aunque sin superar los límites máximos legislados) y una reducción de los fenoles (?10%) en tan solo 6 meses (Zullo et al., 2014).
La eficiencia del filtrado y el desarrollo de microrganismos una vez ejecutado el proceso va a venir determinados cuatro factores:
1. Carga inicial de hongo y levaduras: la mayor carga en el aceite 'velado' de microrganismos en suspensión coloidal podría hacer que se detecten en una concentración de un orden de magnitud.
2. Inoculación cualitativa y cuantitativa de la flora existente en la almazara: la falta de higienización de la instalación, así como el avance de la campaña favorecería que existan puntos que aportarían muchos microrganismos a la pasta de aceituna o al aceite. Mientras algunas investigaciones relacionan la carga microbiológica presente en el fruto que entra en el molino, otros muestran que la población de levaduras presentes en el aceite final es igual a la que coloniza la almazara, mostrando incluso que algunas especies aparecen exclusivamente en determinado equipo o punto del proceso (Mari et al., 2015; Guerrini et al., 2019).
- Este foco de contaminación sería mayor conforme pasa la campaña, y menor conforme de implanten planes de limpieza diaria. Investigadores incluso detectan levaduras endémicas de determinados equipos que aparecen en el aceite final sin que se haya detectado en el fruto. Se podría incluso hablar de una flora autóctona de cada almazara y que podría incluso a dar el sello 'tradicional' al aceite final (Guerrini et al., 2019).
3. Intensidad del filtrado: la supervivencia de los microorganismos va a estar vinculada con la actividad de agua en el aceite. Normalmente el contenido en agua en el aceite “velado” está entre 0,15-0,40%. Contenidos en agua por encima de 0,20% se debe considerar alto, y no solo es suficiente para el desarrollo de microrganismos, sino incluso para activar las enzimas que dañarán la composición del aceite. Ciafardini y Zullo (2022) observan que, en un aceite con una humedad de 0,07% un inóculo de levaduras de 5 órdenes de magnitud se reduce a menos de 2 en 3 meses frente a que en aceites con una humedad superior 0,3% permanece constante la población inoculada inicialmente. Breschi et al. (2022) observaron que el proceso de filtrado no solo puede bajar la carga microbiana de 2,4-5,4 órdenes de magnitud a 0,0-1,9 órdenes, sino que, en el aceite filtrado tiene lugar más rápida la bajada de la población cuantificable (en los primeros 45 días de conservación), mientras que en el aceite sin filtrar se mantiene durante más tiempo la presencia de los microrganismos en suspensión coloidal, siendo la mayor cuantificación entre los días 45 y 180 de conservación, por lo que están más tiempo poniendo en riesgo la calidad del aceite.
4. Composición química del aceite: la mayor o menor alteración por la presencia de un determinado microrganismo va a estar determinado también por la composición de la matriz oleosa, habiéndose comprobado las siguientes influencias
- Contenido en fenoles: como se ha comentado anteriormente, elevados contenidos en fenoles (>500 mg/kg) podría ser tóxico y matar microrganismos, o al menos, inhibir su crecimiento, así como las enzimas excretadas por éstos (se ha observado una inhibición de lipoxigenasa por Penicillium y Fusarium crecidos en 'aceite de oliva' en comparación con su crecimiento en grasa de girasol (Fakas et al., 2010). Un alto contenido en fenoles, además de causar la muerte a muchos microorganismos (Medina et al., 2006), induciría un estado de estrés celular en la que se formen pseudohifas (Zullo y Ciafardini, 2022; Ciafardini y Zullo, 2022). Los beneficios de la toxicidad de los fenoles sobre la fracción biótica pueden ser aportados a un aceite con bajo contenido en fenoles por el coupage con otro aceite con elevado contenido en fenoles (Zulo y Ciafardini, 2022a). Otras investigaciones obtuvieron similares resultados al comparar aceites de oliva vírgenes con 'aceite de oliva' (Medina et al., 2007) o comparando con otras grasas vegetales también refinadas y con similar perfil de ácidos grasos (Karaosmanoglu et al., 2010), mostrando la importancia de la presencia de fenoles en el efecto antimicrobiano de los aceites de oliva.
- Perfil de ácidos grasos: un elevado contenido en ácidos grasos polinsaturados, concretamente de linoleico, podría inhibir el crecimiento de determinados microrganismos (Zullo et al., 2021b; Zullo y Ciafardini, 2022).
Pero estas propiedades antimicrobianas de los fenoles de los aceites de oliva serían aprovechables también a nivel de alimento o comida preparada con dicho aceite. Medina et al. (2006) estudiaron la actividad antimicrobiana de diferentes aceites comestibles, y descubrieron que los aceites del fruto del olivo tenían una fuerte acción bactericida contra las bacterias grampositivas y gramnegativas al elaborar ensaladas y lactonesa. Los compuestos fenólicos de los aceites de oliva fueron identificados y sus concentraciones estimadas. La forma dialdehídica de la decarboximetil oleuropeína y los aglicones ligustrosidos, el hidroxitirosol y el tirosol fueron los compuestos fenólicos que se correlacionaron estadísticamente con la supervivencia bacteriana. Se analizaron los efectos antimicrobianos del aceite de oliva virgen y del aceite de oliva comprado en un mercado minorista de España contra los patógenos transmitidos por los alimentos. Después de cinco minutos de exposición al aceite de oliva virgen se consiguieron reducciones superiores a 4 órdenes de magnitud de una o dos cepas de S. aureus, E. coli O157:H7, L. monocytogenes, Shigella sonnei, S. Enteritidis o Yersinia sp. Las reducciones en el aceite de oliva (no virgen) oscilaron entre más de cuatro órdenes (S. aureus y Yersinia sp.) y menos de un orden (L. monocytogenes).
¿Podría haber un riesgo para la salud o una explotación biotecnológica la presencia de determinados microorganismos?
Lo expuesto hasta ahora indica que, en el aceite final, comercializado, se detectan tanto levaduras como bacterias. Hasta la fecha no se tiene constancia de riesgo alguno para la salud, aunque no debe bajarse la guardia y mantener los estándares de calidad (Palumbo y Harris, 2011). Sobre todo, ante el hecho que nunca habría resultado sospechoso un aceite de oliva virgen como posible fuente de alergia o intoxicación, pues se ha asumido, directamente, como imposible la presencia de microrganismos en el aceite comercializado. Y eso no es cierto, Zullo et al. (2020a) demostró que bacterias coliformes y Escherichia coli inoculadas en muestras de aceite pueden sobrevivir y reproducirse en aceites de oliva vírgenes con bajos contenidos en fenoles mientras que en muestras ricas en fenoles desaparecían a los 15 días de inoculación. En esta línea, pero en aceites de semilla extraída por prensa, se ha identificado Bacillus cereus, reconocida como patogénica (Drewnowska y Swiecicka, 2021; Zullo y Ceafardini, 2022a).
Pero es importante anotar y subrayar que no se han identificado microrganismos patogénicos en los aceites de oliva vírgenes en cuanto a que a lo largo del proceso de elaboración los aniquilaría durante el proceso de batido. Pero no todos los microrganismos se ven afectados negativamente durante el proceso de elaboración, siendo la higiene y prevención de contaminaciones clave hasta que el producto llegue al consumidor.

Riesgos de aflatoxinas y micotoxinas en Aceites de Oliva
Los mohos crecen en materiales vegetales, incluidas las aceitunas, en condiciones cálidas y húmedas, aunque solo los mohos toxigénicos pueden provocar que mínimas cantidades de sus toxinas pasen al aceite final (Palumbo y Harris, 2011).
De forma general las micotoxinas principales son:
- las Aflatoxinas, producidas por Penicillium verrucosum y miembros de Aspergillus sp. También serían producidas por un número de especies de Aspergillus, de los cuales las más importantes en alimentos son Aspergillus flavus y Aspergillus parasiticus. A. flavus produce Aflatoxinas B, mientras que A. parasiticus produce las formas B y G. Las Aflatoxinas son las únicas micotoxinas que no se descomponen por el calor y pueden persistir después del proceso de cocinado.
- La Ocratoxina A es una micotoxina, la más tóxica de todas, producida por ciertas especies de Aspergillus y Penicillium.
La presencia de estas toxinas va a depender de diferentes factores, como la variedad de aceituna, pero, sobre todo, de la calidad de éstas. Una aceituna de calidad, o incluso una aceituna que incluso de aceite de oliva de la categoría virgen, prácticamente tendrá una cantidad indetectable de aflatoxinas o micotoxinas.
Estas micotoxinas son solubles en solventes polares, es decir, teóricamente no solubles en el aceite durante la extracción. No obstante, se ha detectado cantidades en algunos aceites con cantidades no despreciables. No existen niveles de máximos que legislen la presencia en grasas vegetales de acuerdo con el límite actual fijado por la Comunidad Europea en el Reglamento (CE) Nº 1881/2006. Para la mayoría de los productos alimentarios son de <10 ppb de aflatoxina B1 y 4 ppb de aflatoxinas totales, aunque los aceites comestibles no se contemplan específicamente (CE, 2006).

Investigaciones previas de presencia de estas micotoxinas en aceites de oliva ofrecen resultados a tener en consideración. Algunos de estos trabajos muestran los siguientes resultados:
- Daradimos et al. (2000) analizaron 50 muestras de aceites de oliva griego en busca de aflatoxina B1 y la encontraron en el 72% de las muestras analizadas, con un rango de 0,0028 a 0,0157 ppb, límite muy inferior al máximo establecido por la UE.
- Ferracane et al. (2007) analizaron 30 muestras de aceites vírgenes del sur de Italia y de Marruecos, y detectaron de contenidos entre 0,1 a 17,0 ppb de Ocratoxina en el 80% de las muestras analizadas A (con una media de 0,7 ppb), y de 0,54 a 2,50 ppb de aflatoxina B en el 10% de las muestras.
En definitiva, la presencia de micotoxinas no debe ser un problema para los aceites de oliva vírgenes extra, pues de forma general se está por debajo de los límites máximos. No obstante, las malas prácticas y mala calidad de los frutos podrían acarrear algún problema de cumplimiento a un determinado lote y el impacto colateral para el global de los aceites de oliva.
¿Un AOVE probiótico?
Por otro lado, muchas de las especies detectadas en los aceites poseen propiedades que podrían implementar la 'potencialidad' nutricional de los aceites de oliva. Se conoce que algunas levaduras pueden producir antioxidantes naturales, como carotenoides, tocoferoles, glutatión, etc. que pueden ayudar a inhibir la degradación oxidativa de lípidos y mejorar la salud de su huésped (Ciafardini y Zullo, 2020). Estas propiedades cobran más interés ante el hecho que, con pruebas in vitro, algunas de estas levaduras tenían un potencial interés. A día de hoy poco se sabe del potencial empleo como vector de microrganismos probióticos de los aceites de oliva. Alonso-García et al. (2019) demostraron la importancia de una pre-adaptación de bacterias de L. pentosus en aceites de oliva para incrementar su viabilidad, funcionalidad y capacidad de superar estreses en el aceite. Incluso estos autores observaron que no todas las grasas vegetales son óptimas como matriz potencial de estos microrganismos probióticos, siendo mejores el aceite de oliva y las grasas de argán, girasol y linaza frente a soja, maíz o almendra.
Algunos de estos potenciales microrganismos tolerarían las condiciones gastrointestinales y podrían alcanzar y colonizar los intestinos, aunque solo se han realizados ensayos in vitro (Ciafardini y Zullo, 2019; Fancello et al., 2020). Aunque las bacterias han mostrado en muchos trabajos su mayor sensibilidad a su viabilidad en los aceites de oliva vírgenes, Pizzolante et al. (2018) propone la bacteria Pantoea séptica produce carotenoides y bioemulsificadores, Fancello et al. (2020) consideran viables que especies de Bacillus y Lactobacillus rhamnosus puedan ofrecer sus propiedades probióticas por medio de un AOVE.
Entre las propiedades referenciadas por estudios publicados y que se podrían aportar potencialmente a los aceites estarían:
-Propiedades antioxidantes:
- Ciafardini y Zullo (2019) observaron que 24 cepas de 8 especies de levaduras aisladas de aceites de oliva poseían actividad scanvenger (capturadores) de radicales libres, probablemente aportado por su fracción proteica y los glucanos de su pared celular. En un ensayo, estos investigadores introdujeron Wickerrhamomyces anomalus y Sacharomycces boulardii obteniendo un aumento de la capacidad antioxidante en los aceites, en torno a un 25% con respecto al control, en relación directa con la cantidad de biomasa inoculada. Esta mejora sería dependiente del tipo de levadura inoculada (W. anomalus sobrevive más en el aceite que S. boulardii) y aceite empleado (mayor cuanto menor contenido en fenoles). S. boulardii junto con S. cerevisiae son las dos únicas levaduras reconocidas como probióticas (Zullo y Ceafardini, 2019).
- Ayudar a la reducción del colesterol: Zullo y Ciafardini (2019) han investigado que la 'introducción' levaduras que reducirían el colesterol. W. anomalus se muestra como la especie con más actividad en la retirada de colesterol en ensayos in vitro.
Si bien esta utilización aún parece lejos de conseguir y de comprender, es importante anotar que, de acuerdo con la actual legislación europea y del Consejo Oleícola Internacional, no está permitido el incremento de las propiedades de los aceites de oliva con probióticos ni comercializarse bajo la denominación de alguna de las categorías de los aceites de oliva para no confundir a los consumidores y defender la singularidad de las grasas obtenidas a partir de las aceitunas. Por tanto, la ingesta de levaduras por vía de los aceites de oliva vírgenes será la que de forma natural tenga el aceite, pues ni se puede manipular para favorecer su presencia, ni eliminarla con sistemas diferentes a la filtración o decantación (p.e. pasteurizar el aceite).
Aun sin llegar a 'introducir' microrganismos en el aceite a comercializar, parece más próximo que se pudiera desarrollar la idea de que determinada flora endémica de una almazara pudiera favorecer la calidad final. Algunas ideas que se están planteando en CTAEX para un futuro cercano irían en las líneas de:
- Favorecer la actividad ß-glucosidasa, y con ello aumento el contenido final de fenoles en el aceite final,
- Promover levaduras que no solo no perjudiquen las intensidades de atributos positivos (frutado, amargo, picante), sino los potencie o module cualitativamente estos atributos,
- Sembrar o introducir en la flora endémica de la almazara levaduras que incluso 'defienda' de otros microrganismos que puedan ir en contra de la calidad de los aceites de oliva vírgenes extra.
Corolario
En este artículo se muestra que la fracción biótica tiene un importante peso en la calidad final de los aceites de oliva vírgenes, siendo un factor tan importante como las variables de tiempo y temperatura de batido o relación aceite: agua en la centrífuga vertical. El impacto de la carga microbiana, de tanto bacterias, hongos como de levaduras, en todas las partes del proceso, podrían justificar o explicar algunas evoluciones de aceites a lo largo de la conservación en bodega, o el poco 'parecido' entre aceites extractados en Abencor y su escalado a nivel industrial.
Cada día se hace más complejo el proceso de extracción de AOVE, en cuanto sabemos más de los factores que interfieren o afectan sobre sus aromas y compuestos antioxidantes. Pero sigue siendo el mismo proceso de siempre, con la diferencia que se conoce mejor los factores que determinan el producto final, y deseo creciente de controlarlos todos para que nada quede a la suerte.

Los microrganismos siempre han estado ahí afectando al frutado, provocando defectos o reduciendo el amargor. Sin embargo, quizás, hace años, los problemas para obtener AOVE fueron corregidos reduciendo o eliminando los atrojes, optimizando la recolección y filtrando antes los aceites. Sin embargo, ya hoy, se ve que queda margen de mejora y factores que seguir controlando para evitar que 'los invitados invisibles' tergiversen la calidad potencial que se pueden obtener.
En el futuro, estos nuevos 'okupas silenciosos' en el proceso de elaboración de aceites, estarán más considerados como factor a tener en cuenta para obtener calidad, siendo importante tener en consideración su interferencia en el AOVE final, y la necesidad de seguir estableciendo medidas higiénicas y de control para que la calidad deseada se obtenga, así como que la calidad lograda en la almazara, llegue al consumidor.
Bibliografía
Alonso-García, E., Pérez-Montoro, B., Benomar, N., Castillo-Gutiérrez, S., Estudillo-Martínez, D., Knapp, C., Abriou, H (2019). New insights into the molecular effects and probiotic properties of Lactobacillus pentosus pre-adapted to edible oils. LWT – Food Science and Technology, 109:153-162.
Angerosa, F. (2002). Influence of volatile compounds in virgin olive oil quality evaluated by analytical approaches and sensor panels. European Journal of Lipid Science and Technology, 104:639-660.
Angerosa, F., Lanza, B., Marsilio, V. (1996). Biogenesis of “fusty” defect in virgin olive oils. Grasas y Aceites, 47 (3):142-150.
Azevedo-Nogueira, F., Gomes, S., Carvalho, T., Martins-Lopes, P. (2020). Development of high-throughput real-time PCR assays for the Colletotrichum acutatum detection on infected olive fruits and olive oils. Food Chemistry, 317: 126417.
Breschi, c., Guerrini, L., Parenti, A., Piernícola, M., Luca, C., Lunetti, L., Zanoni, B. (2022). Turbidity characterization as a decision-making tool for extra virgin olive oil stability treatmens. Food Control, 137:108931.
Cacciola, S. O., Faedda, R., Sinatra, F., Agosteo, G. E., Schena, L., Frisullo, S., di San Lio, G. M. (2012). Olive anthracnose. Journal of Plant Pathology, 94:29-44.
Cayuela, J.A., Gómez-Coca, R.B., Moreda, W., Pérez-Camino, M.C. (2015). Sensory defects of virgin olive oil from a microbiological perspective. Trends in Food Science Technology, 43: 227-235.
Cayuela, J.A., Caballero-Guerrero, B. (2019). Interacciones entre acidez y estado coloidal en el aceite de oliva virgen. XIX Simposio Científico-Técnico EXPOLIVA 2019. Jaén.
Cayuela, J.A. (2021). Captative fatty acids of fresh olive oils? Grasas y Aceites, 72.
Ciafardini, G., Cioccia, G., Zullo, B.A. (2017). Taggiasca extra virgin olive colonization by yeast during the extraction process. Food Microbiology, 62:58-61.
Ciafardini, G., Zullo, B. A. (2002a). Microbiological activity in stored olive oil. International Journal of Food Microbiology, 75:111-118.
Ciafardini, G., Zullo, B. A. (2002b). Survival of micro-organisms in extra virgin olive oil during storage. Food Microbiology, 19:105-109.
Ciafardini, G., Zullo, B. A. (2020). In vitro potential antioxidant activity of indigenous yeasts isolated from virgin olive oil. Journal of Applied Microbiology, 128(3), 853-861.
Ciafardini, G., Zullo, B. A. (2022). Microbiological an enziymatic activity modulates the bitter taste reduction in decanted coratina olive oil. Foods, 11:867.
Daradimos, E., P. Marcaki, M. Koupparis. 2000. Evaluation and validation of two fluorometric HPLC methods for the determination of aflatoxin B1 in olive oil. Food Additives & Contaminants: Part A, 17 (1): 65-73.
Dourou, A.M., Brizzolara, S., Meoni, G., Tenori, L., Famiani, F., Luchinat, C., Tonutti, P. (2019). The inner temperature of the olives Leccino before processing affects the volatile profile and the composition of the oil. Food Research International, 129.
Drewnowska, J. M., Swiecicka, I. (2021). Microbiological insight into cold-pressed oils by cultural and metataxonomic analysis. Food Bioscience, 42: 101150.
Fakas, S., Kefalogianni, I., Makri, A., Tsoumpeli, G., Rouni, G., Gardeli, C., Papanikolaou, S. Aggelis, G. (2010). Characterization of olive fruit microflora and its effect on olive oil volatile compounds biogenesis. European Journal of Lipid Science and Technology, 112(9):1024-1032.
Fancello, F., Multineddu, C., Santona, M., Deiana, P., Zara, G., Mannazzu, I., Budroni, M., Dettori, S., Zara, S. (2020). Bacterial biodiversity of extra virgin olive oils and their potential biotechnological exploitation. Microorganisms, 8(1):97.
Ferracane, R., A. Tafuri, A. Logieco, F. Galvano, D. Balzano, and A. Ritieni. (2007). Simultaneous determination of aflatoxin B1 and ochratoxin A and their natural occurrence in Mediterranean virgin olive oil. Food Additives & Contaminants; Part A, 24 (2): 173-180.
García-Mesa, J.A., Sánchez-Ortíz, A. (2017). Efecto de la falta de limpieza en la calidad de los aceites vírgenes obtenidos. Simposium Científico-Técnico EXPOLIVA 2017. Jaén.
García-Mesa, J.A. (2018). La limpieza en almazaras. Parte I: Situación actual. Tecnología y Equipos de Almazaras, 19:18-25.
Gomes, S., Prieto, P., Carvalho, T., Guedes-Pinto, H., Martins-Lopes, P. (2021). Olive – Colletotrichum acutatum: An Example of Fruit-Fungal Interaction. Plant Breeding. Edited by Ibrokhim Y. Abdurakhmonov. Disponible en: https://www.intechopen.com/chapters/25560
Gouvinhas, I., Martins-Lopes, P., Carvalho, T., Barros, A., Gomes, S. (2019). Impact of Colletotrichum acutatum pathogen on olive phenylpropanoid metabolism. Agriculture, 9(8):173.
Guerrini, S., Mati, E., Migliorini, M., Cherubini, C., Trapani, S., Zanoni, B., Vincenzini, M. (2015). Investigation on microbiology of olive oil extraction process. Italian Journal of Food Science, 27:236-247.
Guerrini, S., Mari, E., Barbato, D., Granchi, L. (2019). Extra Virgin Olive Oil quality as affected by yeast species occurring in the extraction process. Foods, 8:457.
Guerrini L., Corti, F., Cecchi, L., Mulinacci, N., Calamai, L., Massella, P., Angeloni, G., Spadi, A., Parenti, A. (2021) Use of refrigerated cells for olive cooling and short-term storage: qualitative effects on EVOO. International Journal of Refrigeration, 127:59-68.
Karaosmanoglu, H., Soyer. F., Ozen, B., and Tokatli, F. (2010). Antimicrobial and antioxidant activities of Turkish extra virgin olive oils. Journal of Agricultural and Food Chemistry, 58:8238-8245.
Iannotta, I., Perri, E., Siriani, R., Tocci, C. (1999). Influence of Colletotrichum gloeosporioides (Penzing) and Camarosporium dalmatica (Thum) attacks on olive oil quality. Acta Horticulturae, 474: 399–401.
Leoni, C., Bruzzone, J., Villamil, J. J., Martínez, C., Montelongo, M. J., Betancur, O. (2018). Percentage of anthracnose (Colletotrichum acutatum s.s.) acceptable in olives for the production of extra virgin olive oil. Crop Protection, 108, 47–53.
Mari, E., Guerrini, S., Granchi, L., Vicenzini, M. (2015). Investigation on microbiota of extra virgin olive oil extraction process. Tesis Doctoral, Universidad degli Studi Firenze.
Medina, E., de Castro, A. Romero, C., Brenes, M. (2006). Comparison of the concentrations of phenolic compounds in olive oils and other plant oils: Correlation with antimicrobial activity. Journal of Agricultural and Food Chemistry, 54: 4954-4961.
Medina, E., Romero, C. Brenes, M., Castro, A.D. (2007). Antimicrobial activity of olive oil, vinegar, and various beverages against foodborne pathogens. Journal of Food Protection, 70(5):1194-1199.
Montaño, A. (2019). El paradigma del lavado de las aceitunas en la almazara. Tecnología y Equipos para Almazaras. 17: 12-22.
Montaño, A., Redondo, S. (2021). Paradigmas del filtrado de los Aceites de Oliva Vírgenes. Tecnología y Equipos para Almazaras. 24: 34-48.
Moral, J., Agustí-Brisach, C., Raya, M. C., Jurado-Bello, J., López-Moral, A., Roca, L. F., Chattaoui, M., Rhouma, A., Sergeeva, V., Trapero, A. (2021). Diversity of Colletotrichum Species Associated with Olive Anthracnose Worldwide. Journal of Fungi, 7(9), 741.
Morales, M.T., Luna, G., Aparicio, R. (2005). Comparative study of virgin olive oil sensory defects. Food Chemistry, 91:293-301.
Palumbo, M., Harris, L.H. (2011). Microbiological Food Safety of Olive Oil: A Review of the Literature. Disponible en: www.olivecenter.ucdavis.edu
Peres, F. Talhinhas, P., Afonso, H., Alegre, H., Oliveira, H., Ferreira-Dias, S. (2021). Olive Oil from fruits infected with different anthracnose atoghens show sensory defects earlier than chemical degradation. Agronomy, 11:1041.
Pizzolante, G.; Durante, M.; Rizzo, D.; Di Salvo, M.; Tredici, S.M.; Tufariello, M.; De Benedetto, G.E. (2018). Characterization of two Pantoea strains isolated from extra-virgin olive oil. AMB Express, 8:113.
Raaijmakers, J. M. (2017). Smelly fumes: volatile-mediated communication between bacteria and other organisms: Research Topic. Frontiers in Microbiology.
Romero, A. (2011). Caracterización y diferenciación de los aceites vírgenes de oliva de la comarca del Priorat (Tarragona) dentro del mercado global de aceites de la variedad’Arbequina’. Tesis Doctoral. Universidad de Lleida.
Romero, J., Santa-Bárbara, A.E., Moral, J., Agustí-Brisach, C., Roca, L.F., trapero, A. (2022). Effect of latent and symptomatic infections by colletotrichum godetiae on oil quality. European Journal of Plant Pathology, 163:545-556.
Romo-Sánchez, S., Alves-Baffi, M., Arévalo-Villena, M., Úbeda-Iranzo, J., Briones-Pérez, A. (2010). Yeast biodiversity from oleic ecosystems: study of their biotechnological properties. Food Microbiology, 27: 487-492.
Santona, M. (2017). Olive zoning: Analysis of Environmental: Influences on Monovarietal Olive Oils (Bosana cultivar). Università Degli Studi di Sassari: Sassari, Italy.
Santona, M.; Sanna, M.L.; Multineddu, C.; Fancello, F.; de la Fuente, S.A.; Dettori, S.; Zara, S. (2018). Microbial biodiversity of Sardinian oleic ecosystems. Food Microbiology, 70: 65–75.
Sanz, L.C, Pérez, A.G., Olías, J.M., (1992). La lipoxigenasa en el reino vegetal. I. Propiedades. Grasas y Aceites, 43:231-239.
Talhinhas, P., Loureiro, A., Oliveira, H. (2018). Olive anthracnose: a yield-and oil quality-degrading disease caused by several species of Colletotrichum that differ in virulence, host preference and geographical distribution. Molecular Plant Pathology, 19(8):1797-1807.
Torres-Vila, L. M., Rodríguez-Molina, M. C., & Martínez, J. A. (2003). Efectos del daño de la mosca del olivo y del atroje sobre la microflora en pasta y la acidez del aceite virgen de oliva. Grasas Aceites, 3: 285-294.
Vichi, S., Romero, A., Tous, J., Caixach, J. (2011). The activity of healthy olive microbiota during virgin olive oil extraction influences oil chemical composition. Journal of Agricultural and Food Chemistry, 59:4705-4714.
Vichi, S., Boyrmegri, P., Caixach, J., Romero, A. (2015). Quality loses in virgin oive oils due to washing and short-term storage before olive milling. European Journal of Lipid Science, 117:2015-2022.
Zullo, B.A., Cioccia, G., Ciafardini, G. (2013). Effects of some oil-born yeast on the sensory characteristics of Italian virgin olive oil during storage. Food Microbiology, 36:70-78.
Zullo, B. A., Di Stefano, M. G., Cioccia, G., Ciafardini, G. (2014). Evaluation of polyphenol decay in the oily fraction of olive fruit during storage using a mild sample handling method. European Journal of Lipid Science and Technology, 116(2):160-168.
Zullo, B. A., Ciafardini, G. (2019). Evaluation of physiological properties of yeast strains isolated from olive oil and their in vitro probiotic trait. Food Microbiology, 78:179-187.
Zullo, B. A., Ciafardini, G. (2020a). Differential microbial composition of monovarietal and blended extra virgin olive oils determines oil quality during storage. Microorganisms, 8(3):402.
Zullo, B. A., Ciafardini, G. (2020b). Virgin olive oil quality is affected by the microbiota that comprise the biotic fraction of the oil. Microorganisms, 8(5):663.
Zullo, B. A., Ciafardini, G. (2022). Role of the yeast in the qualitative structuring of extra virgin olive oil. Journal of Applied Microbiology, 12:4033-4041.
Zullo, B.A., Venditti, G., Ciafardini, G. (2021). Effects of the filtration on the biotic fraction of extra virgin olive oil. Foods, 10:1677.