Estrategias para mejorar la inmunidad bajo condiciones de estrés metabólico
Escalera-Moreno N.1, Álvarez-Rodríguez J.1, Martín-Alonso M.J.1, Molina E.1, Villalba D.1, Serrano-Pérez B.1,2
1 Departamento de Ciencia Animal, Universitat de Lleida
2 Agrotecnio-Cerca Center, Universitat de Lleida
Las enfermedades de origen metabólico o relacionadas con él se ven acentuadas durante el periodo periparto y durante las situaciones de alto rendimiento como pueden ser las fases de desarrollo o el periodo de lactación en el ganado bovino. Por ello, un buen sistema inmunitario es fundamental para mantener la salud y el rendimiento de la vaca cuando tiene que afrontar estas situaciones de estrés.
El ganado vacuno actual ha sido seleccionado para obtener cada vez un mayor rendimiento productivo, ya sea de aptitud cárnica o lechera. Esta condición conlleva unas necesidades físicas y nutricionales cada vez más exigentes que se oponen a, en ocasiones, la minimización de costes de la explotación mediante la restricción de la dieta o el uso de pastos de baja calidad como ocurre en el ganado vacuno de aptitud cárnica (Sanz et al, 2004). En el caso del ganado vacuno de aptitud lechera, el desafío surge del desequilibrio entre la energía necesaria para la lactación y la energía proporcionada por el consumo de materia seca (Esposito et al., 2014). Si la homeostasis fisiológica se ve afectada puede tener como resultado que el animal sufra estrés metabólico. El estrés metabólico puede definirse como un desequilibrio en la homeostasis de un organismo vivo como consecuencia de una utilización anómala de los nutrientes, bien por exceso o por defecto (Lacetera, 2016). Hay que tener en cuenta, también, que estas restricciones nutricionales pueden surgir de forma natural debido a climatologías adversas. Si el estrés se da de manera prolongada o tiene gran magnitud, la respuesta al mismo supondrá un coste energético elevado para el animal. Por otro lado, cuando el estímulo que causa el estrés desaparece, normalmente la respuesta que desencadenó en el organismo también cesa.
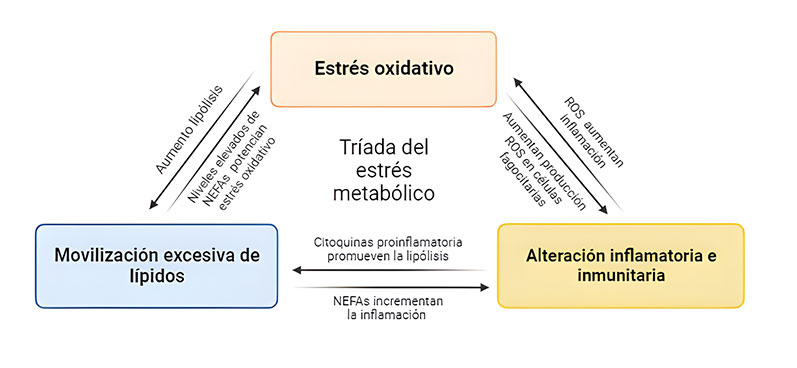
El estrés metabólico se caracteriza por una lipomovilización excesiva, una disfunción inmune e inflamatoria, y estrés oxidativo, como consecuencia de las respuestas catabólicas (Abuelo et al., 2019). Estos procesos se encuentran interconectados, de manera que los cambios fisiológicos derivados exacerban las enfermedades metabólicas o desordenes clínicos o subclínicos, muy comunes en muchas ganaderías, sobre todo en vacas lecheras (Sordillo y Raphael, 2013). Por ejemplo, terneros nacidos de vacas lecheras que durante el último tercio de la gestación sufrieron estrés metabólico, mostraron menores pesos vivos al nacer, una respuesta inmunitaria alterada y mayor estrés oxidativo que se podría asociar a una mayor susceptibilidad a enfermedades (Ling et al., 2018).
Para contrarrestar estos efectos negativos a nivel fisiológico, se producirá un balance entre los factores prooxidantes y antioxidantes. Hay dos tipos de sistemas de defensa: los enzimáticos, como la superóxido dismutasa o la catalasa, y los no enzimáticos como las vitaminas C y E, y el selenio (Celi y Gabai, 2015). Además, las células inmunitarias se valen de vías de señalización capaces de detectar el estado nutritivo y/o energético, pudiendo así ajustar las respuestas proinflamatorias o antiinflamatorias según se necesite (Arnott et al., 2012; Rutherford et al., 2014; Lindsay et al., 2019). Sin embargo, el estrés oxidativo actuaría como nexo entre el metabolismo energético alterado y el sistema inmunitario de la vaca durante la etapa periparto (Celi y Gabai, 2015). El estrés oxidativo y la inflamación son interdependientes, y se potencian el uno al otro ya que un exceso de especies reactivas de oxígeno iniciará una serie de señalizaciones intracelulares que derivarán en respuestas proinflamatorias. Por otra parte, se producirá una peroxidación lipídica, debido a un mayor funcionamiento en las vías catabólicas para generar energía a partir de lípidos y aminoácidos. Ésta se basa en una reacción en cadena de radicales libres que forman hidroperóxidos lipídicos y productos secundarios que interaccionan con el resto de las macromoléculas intracelulares, causando daños estructurales y entorpeciendo su funcionamiento (Rutherford et al., 2014; Lindsay et al., 2019).

Estrés metabólico y sistema inmunitario
Tanto la inmunidad innata como la adaptativa cuentan con componentes celulares y componentes humorales que se encuentran en los fluidos orgánicos. Los receptores de las células de la inmunidad adaptativa son únicos ya que se producen aleatoriamente y son capaces de reconocer cualquier parte del microorganismo o sus productos. Las células de la inmunidad innata tienen receptores ya preformados que detectan estructuras repetidas en los patógenos (PAMPs, del inglés pathogen-associated molecular patterns) o señales de peligro enviadas por los tejidos (DAMPs, del inglés danger-associated molecular patterns). Entre las señales detectadas se encuentran las catecolaminas, el cortisol, los metabolitos de microbiota comensal, el ácido úrico, la glucosa, el ATP o las proteínas de choque térmico que activarían la inmunidad innata en ausencia de patógenos en lo que se conoce como ‘inflamación estéril’ (revisado por Fleshner, 2013).
La activación de la respuesta inmunitaria como consecuencia de un estrés metabólico puede estar asociada a medidas adaptativas que potenciarán la inmunidad innata frente a patógenos, gracias a la movilización de energía o cambios conductuales asociados a la enfermedad (Lacetera, 2016). En condiciones de déficit energético, se producirá un intercambio energético con los sistemas fisiológicos. De modo que, una mayor inversión en el sistema inmunitario implicará el deterioro de la función reproductiva por una menor asignación de energía como se ha observado en algunos estudios previos (Friggens et al., 2010).
Estrés metabólico y estrés agudo-crónico en el ganado vacuno
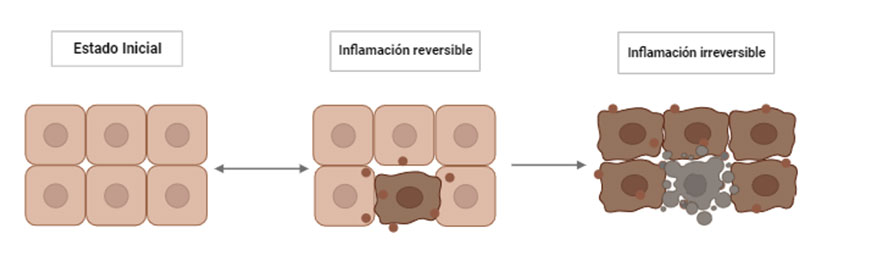
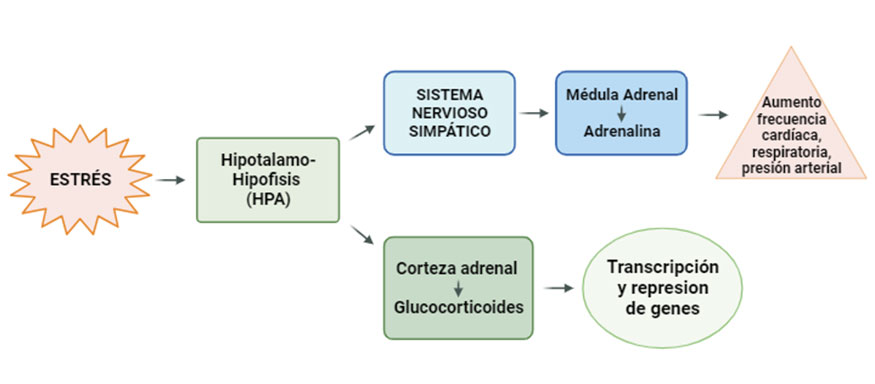
El estrés metabólico también puede estar asociado a respuestas frente a estresores que pueden ser agudos o crónicos. La respuesta fisiológica comienza con la activación del eje hipotálamo-hipófisis-adrenal (HPA), el sistema nervioso autónomo y el sistema inmunitario, a través de sus intermediarios como pueden ser los glucocorticoides, catecolaminas y citoquinas, respectivamente. La activación de esta respuesta conlleva el incremento de la presión arterial, la frecuencia cardiaca, la elevación de niveles de glucocorticoides y la función cognitiva alterada (McEwen, 2002). Los cambios fisiológicos debidos al estrés pueden derivar en enfermedades metabólicas o desordenes clínicos o subclínicos, muy comunes en muchas ganaderías, sobre todo en vacas lecheras, ya que como hemos comentado anteriormente, el estrés incrementaría el estado inflamatorio vía DAMPs (Sordillo y Raphael, 2013).
Los estresores pueden ser externos o internos y todos ellos activaran el eje HPA generando una respuesta al estrés, la cual se verá reflejada fisiológicamente y en ocasiones también conductualmente. Los principales factores capaces de causar estrés en el ganado pueden ser ambientales, ya sean por cambios bruscos de la climatología o por temperaturas extremas durante largos periodos de tiempo, y pueden ser también los relacionados con el régimen de vida, como las instalaciones de la explotación ganadera y su mantenimiento. Además, se debe tener en cuenta el estrés psicológico asociado a un mal manejo, como eventos inesperados que causen turbación en el animal, frustración por estar aislados, trasporte, destete o cualquier otro tipo de situación traumática (Odeón y Romera, 2017).
La nutrición es un factor muy importante ya que padecer sed, hambre o ingerir alimentos inadecuados causará malestar en el animal, incrementando las respuestas de estrés, por ejemplo, si la vaca se encuentra en el periodo preparto o postparto. Por otro lado, la alimentación permitiría administrar productos que ayuden a reducir el estrés metabólico.
Por último, padecer enfermedades, lesiones o no tratarlas de forma adecuada supondrá para la vaca un alto estrés además de un mayor gasto energético.
Los factores estresantes tienen un efecto aditivo, es decir, cuando el animal padece varios estresores al mismo tiempo, la respuesta resultante será mayor que si al animal solo le afectara un factor (Odeón y Romera, 2017).
Estrategias para ayudar a mejorar la inmunidad en condiciones de estrés metabólico
- Manejo del estrés. Minimizar el estrés producido por agentes físicos externos en el ganado bovino es esencial. Esto incluye proporcionar un ambiente adecuado con suficiente sombra o refugio (evitando estrés térmico), un programa de manejo adecuado y reducir las situaciones estresantes, como ruidos fuertes, siempre que sea posible. En general, seguir la línea de las prácticas de bienestar (higiene, espacio, desinfecciones de las instalaciones, etc.) recomendadas proporciona un ambiente más adecuado para prevenir que los animales padezcan de estrés por factores físicos externos.
- Medicina preventiva. Llevar a cabo labores de prevención como puede ser mantener un programa de vacunación adecuado y un control eficaz de las enfermedades es esencial para prevenir periodos de inmunosupresión en el ganado.
- Seguimiento y monitorización. Realizar un seguimiento constante de la salud del ganado, especialmente en momentos donde se pueda dar un mayor estrés metabólico, como en el periparto, permitirá observar signos de enfermedades, cambios en la condición corporal, y cualquier otro indicio de problemas de salud, para realizar una rápida actuación.
- Nutrición adecuada. La nutrición desempeña un papel fundamental en la inmunidad del ganado bovino. Durante situaciones de estrés metabólico, es esencial proporcionar una dieta equilibrada que cumpla con las necesidades nutricionales del ganado. Se han publicado una gran cantidad de trabajos donde se pueden ver diferentes estrategias (Estaún et al., 2014; Khatti et al., 2017; Chiofalo et al., 2020).
Utilización de polifenoles y otros compuestos antioxidantes
Como hemos visto anteriormente, el mantenimiento del equilibrio redox es esencial para evitar desórdenes metabólicos. Los antioxidantes como los polifenoles desempeñan un papel importante al proteger al organismo de radicales libres debido a su papel inmunomodulador, que implica la inhibición de citoquinas inflamatorias, y la promoción de defensas antioxidantes (Celi y Gabai, 2015). Es por ello, que el uso de polifenoles es una estrategia prometedora para prevenir o aliviar el estrés oxidativo relacionado con una nutrición deficiente, en situaciones de alta demanda energética como puede ser durante el último tercio de gestación y durante la lactación, afectando positivamente el desarrollo postnatal de los lechones cuyas madres habían recibido antioxidantes en la dieta (García-Contreras et al., 2019; Vázquez-Gómez et al., 2019).
Se espera que la inclusión de aditivos antioxidantes en la dieta module los efectos negativos de las vacas con estrés metabólico, y en fases como la gestación se espera que también se trasmita este efecto positivo a la descendencia durante la vida postnatal. Por ejemplo, se ha demostrado que algunos tratamientos con polifenoles pueden ser una forma positiva de protección de la neurogénesis y la función cognitiva en la descendencia que ha sufrido estrés en la etapa prenatal (Zheng et al., 2015). En este sentido, la suplementación con polifenoles procedentes del orujo de oliva en la dieta materna ha conseguido mejorar el peso de la descendencia (Vázquez-Gómez et al., 2017) y modificar la composición del calostro y la leche materna (Laviano et al., 2023), posiblemente mediante un aumento de la capacidad de absorción de glucosa (Hadrich et al., 2016).
Por otro lado, la inclusión de polifenoles y otros antioxidantes podría prevenir o amortiguar la metilación del ADN asociada con el estrés oxidativo. La metilación del ADN es un proceso donde se añaden grupos metilos al ADN, modificando la función de éste si se da en una zona de iniciación de la transcripción o gen promotor, frenando la misma (Vázquez-Gómez et al., 2019).
Los polifenoles hidrofílicos los podemos encontrar, entre otros ingredientes, en los orujos de oliva que son ricos en compuestos como el tirosol, el hidroxitirosol, oleuropeina, oleocantal y verbascosido, los cuales presentan uno o más anillos fenólicos, con diversas acciones farmacológicas, debido a sus propiedades antioxidantes, además de efectos antiinflamatorios, cardioprotectivos, antiangiogénicos, antidiabéticos y neuroprotectivas (Mallamaci et al., 2021).
Además, cabe destacar que en un contexto de economía circular dentro de la Agenda 2030 para el Desarrollo Sostenible se valorizarían estos residuos, que actualmente se han vendido como subproductos de bajo valor económico.
Existen estudios en los que utilizan vitamina E y selenio con propiedades antioxidantes que pueden ayudar a equilibrar la producción de oxidantes y antioxidantes del organismo que sufre estrés oxidativo y por tanto mejorar la salud del ganado durante el periodo periparto (Khatti et al., 2017; Xiao et al., 2021). Recientemente, se han valorado los efectos de la utilización independiente y combinada de vitamina E e hidroxitirosol en la dieta materna, evidenciando una mejora del estado oxidativo de la descendencia en todos los casos, pero únicamente mejorando los rendimientos productivos en lactación en el caso del suplemento con vitamina E en las madres (Gomez et al., 2023).
Aunque se espera que el uso de este tipo de compuestos mejore tanto el estado fisiológico y metabólico del animal como el bienestar del animal que sufre estrés metabólico, siguen siendo necesarios más estudios para valorar la respuesta en función de la dosis o los niveles de estrés a los que este expuesto el animal en cada momento.
Agradecimientos
Este trabajo se ha realizado en el marco del Proyecto financiado por MCIN/AEI/ 10.13039/501100011033 (Fetalnut). N. Escalera-Moreno disfruta de un contrato predoctoral de la Universitat de Lleida.
Bibliografía
- Abuelo, A., Hernández, J., Benedito, J. L., & Castillo, C. (2019). Redox biology in transition periods of dairy cattle: Role in the health of periparturient and neonatal animals. Antioxidants, 8(1), 20.
- Arnott, G., Roberts, D., Rooke, J. A., Turner, S. P., Lawrence, A. B., & Rutherford, K. M. D. (2012). Board invited review: the importance of the gestation period for welfare of calves: maternal stressors and difficult births. Journal of Animal Science, 90(13), 5021-5034.Celi, P., & Gabai, G. (2015). Oxidant/antioxidant balance in animal nutrition and health: the role of protein oxidation. Frontiers in Veterinary Science, 2, 48.
- Chiofalo, V., Liotta, L., Lo Presti, V., Gresta, F., Di Rosa, A. R., & Chiofalo, B. (2020). Effect of dietary olive cake supplementation on performance, carcass characteristics, and meat quality of beef cattle. Animals, 10(7), 1176.
- Esposito, G., Irons, P. C., Webb, E. C., & Chapwanya, A. (2014). Interactions between negative energy balance, metabolic diseases, uterine health and immune response in transition dairy cows. Animal Reproduction Science, 144(3-4), 60-71.
- Estaún, J., Dosil, J., Al Alami, A., Gimeno, A., & De Vega, A. (2014). Effects of including olive cake in the diet on performance and rumen function of beef cattle. Animal Production Science, 54(10), 1817-1821.
- Fleshner, M. (2013). Stress-evoked sterile inflammation, danger associated molecular patterns (DAMPs), microbial associated molecular patterns (MAMPs) and the inflammasome. Brain, Behavior, and Immunity, 27, 1-7.
- Friggens N.C., Disenhaus C., Petit H.V. (2010). Nutritional sub-fertility in the dairy cow: towards improved reproductive management through a better biological understanding. Animal, 4, 1197–213.
- Garcia-Contreras, C., Vazquez-Gomez, M., Barbero, A., Pesantez, J. L., Zinellu, A., Berlinguer, F., ... & Gonzalez-Bulnes, A. (2019). Polyphenols and IUGR pregnancies: Effects of maternal hydroxytyrosol supplementation on placental gene expression and fetal antioxidant status, DNA-methylation and phenotype. International journal of molecular sciences, 20(5), 1187.
- Gómez, G.; Laviano, H.D.; García-Casco, J.M.; Escudero, R.; Muñoz, M.; Heras-Molina, A.; González-Bulnes, A.; Óvilo, C.; López-Bote, C.; Rey, A.I. (2023). Different Effect of Vitamin E or Hydroxytyrosol Supplementation to Sow’s Diet on Oxidative Status and Performances of Weaned Piglets. Antioxidants, 12, 1504.
- Hadrich F., Garcia M., Maalej A., Modes M., Isoda H., Feve B., Sayadi S. (2016). Oleuropein activated AMPK and induced insulin sensitivity in C2C12 muscle cells. Life Science, 151, 167–173.
- Khatti, A., Mehrotra, S., Patel, P. K., Singh, G., Maurya, V. P., Mahla, A. S., ... & Krishnaswamy, N. (2017). Supplementation of vitamin E, selenium and increased energy allowance mitigates the transition stress and improves postpartum reproductive performance in the crossbred cow. Theriogenology, 104, 142-148.
- Lacetera, N. (2016). Metabolic stress, Heat Shock Proteins, and Innate Immune Response. In The Innate Immune Response to Noninfectious Stressors; Amadori, M., Ed.; Academic Press: London, UK, pp. 107–131.
- Laviano H.D., Gómez G., Muñoz M., García-Casco J.M., Nuñez Y., Escudero R., Molina A.H., González-Bulnes A., Óvilo C., López-Bote C., Rey A.I. (2023). Dietary Vitamin E and/or Hydroxytyrosol Supplementation to Sows during Late Pregnancy and Lactation Modifies the Lipid Composition of Colostrum and Milk. Antioxidants (Basel). 12(5):1039.
- Lindsay, K. L., Buss, C., Wadhwa, P. D., & Entringer, S. (2019). The interplay between nutrition and stress in pregnancy: implications for fetal programming of brain development. Biological Psychiatry, 85(2), 135-149.
- Ling, T., Hernandez-Jover, M., Sordillo, L. M., & Abuelo, A. (2018). Maternal late-gestation metabolic stress is associated with changes in immune and metabolic responses of dairy calves. Journal of Dairy Science, 101(7), 6568-6580.
- Mallamaci, R., Budriesi, R., Clodoveo, M. L., Biotti, G., Micucci, M., Ragusa, A., ... & Franchini, C. (2021). Olive tree in circular economy as a source of secondary metabolites active for human and animal health beyond oxidative stress and inflammation. Molecules, 26(4), 1072.
- McEwen, B. S. (2002). Sex, stress and the hippocampus: allostasis, allostatic load and the aging process. Neurobiology of Aging, 23(5), 921-939.
- Miyake, K., & Fukui, R. (2016). Homeostatic inflammation as environmental-adaptation strategy. In The Innate Immune Response to Noninfectious Stressors (pp. 25-52). Academic Press.
- Rutherford, K. M., Piastowska-Ciesielska, A., Donald, R. D., Robson, S. K., Ison, S. H., Jarvis, S., ... & Lawrence, A. B. (2014). Prenatal stress produces anxiety prone female offspring and impaired maternal behaviour in the domestic pig. Physiology & Behavior, 129, 255-264.
- Odeón, M. M., & Romera, S. A. (2017). Estrés en ganado: causas y consecuencias. Revista Veterinaria, 28(1), 69-77.
- Sanz, A., Bernués, A., Villalba, D., Casasús, I., & Revilla, R. (2004). Influence of management and nutrition on postpartum interval in Brown Swiss and Pirenaica cows. Livestock Production Science, 86(1-3), 179-191.
- Sordillo LM, Raphael W. (2013). Significance of metabolic stress, lipid mobilization, and inflammation on transition cow disorders. Veterinary Clinics of North America: Food Animal Practice. 29(2), 267-78
- Stefanon, B., Sgorlon, S., & Gabai, G. (2005). Usefulness of nutraceutics in controlling oxidative stress in dairy cows around parturition. Veterinary Research Communications, 29(2), 387-390.
- Vázquez-Gómez M., Garcia-Contreras C., Torres-Rovira L., Pesantez J.L., González-Añover P., Gomez-Fidalgo E., et al. (2017) Polyphenols and IUGR pregnancies: Maternal hydroxytyrosol supplementation improves prenatal and early-postnatal growth and metabolism of the offspring. PLoS ONE 12(5): e0177593.
- Vázquez-Gómez M, Heras-Molina A, Garcia-Contreras C, Pesantez-Pacheco JL, Torres- Rovira L, Martínez-Fernández B, González J, Encinas T, Astiz S, Óvilo C, Isabel B, González-Bulnes A. 2019. Polyphenols and IUGR pregnancies: Effects of maternal hydroxytyrosol supplementation on postnatal growth, metabolism and body composition of the offspring. Antioxidants, 8: 535.
- Xiao, J., Khan, M. Z., Ma, Y., Alugongo, G. M., Ma, J., Chen, T., ... & Cao, Z. (2021). The antioxidant properties of selenium and vitamin E; their role in periparturient dairy cattle health regulation. Antioxidants, 10(10), 1555.
- Zheng, A., Li, H., Cao, K., Xu, J., Zou, X., Li, Y., ... & Feng, Z. (2015). Maternal hydroxytyrosol administration improves neurogenesis and cognitive function in prenatally stressed offspring. The Journal of Nutritional Biochemistry, 26(2), 190-199.






