El cultivo in vitro de embriones y óvulos en la mejora de variedades tempranas de melocotonero
Introducción
La mejora hacia variedades de bajas necesidades de frío comenzó ya en 1907 en Estados Unidos, primero en la Universidad de California, y posteriormente en la Universidad de Florida. Otros países tradicionalmente obtentores de variedades 'low chilling' de melocotonero son Sudáfrica, Brasil, Chile, Méjico y más recientemente se han incorporado Taiwán, Australia y Tailandia (TOPP et al., 2008). En España, 9 de los 13 programas de mejora activos en la actualidad, ubicados fundamentalmente en las zonas del sur (Valencia, Andalucía, Murcia y Extremadura) se enfocan hacia la obtención de variedades tempranas y extra-tempranas adaptadas a las condiciones Mediterráneas (Llácer et al., 2009).
El principal obstáculo con el que se encuentran los mejoradores de melocotón y nectarina cuando trabajan con parentales de maduración temprana, es la escasa o nula viabilidad de las semillas de estas variedades cuando se germinan por métodos convencionales, es decir, por estratificación húmeda y germinación en semillero.

Con la introducción de técnicas de cultivo de óvulos y embriones se puede lograr la obtención de plantas a partir de semillas inmaduras y por tanto mejorar enormemente la eficiencia de los programas de mejora.
Las técnicas in vitro aumentan los costes y requieren cierta especialización, pero reducen espacio y tienden a acortar los largos programas de mejora. Una vez implantada la técnica del cultivo de embriones, merece la pena abordar el cultivo de óvulos para los parentales más tempranos, optimizando al máximo la técnica para amortizar costes y alcanzar mayores porcentajes de germinación en el mismo año y, en definitiva, obtener progenies con una maduración lo suficientemente temprana como para empezar el proceso de selección lo antes posible.
Cultivo de embriones
La técnica del cultivo de embriones permite rescatar el zigoto en diferentes estados de desarrollo y completar su crecimiento en un medio artificial que le aporta las sales minerales, las vitaminas y los azúcares que necesita. Una vez colocado en el medio, el embrión aumenta de tamaño, es capaz de germinar y posteriormente la plántula puede ser transplantada a tierra de igual forma que se haría con una planta procedente de semilla germinada in vivo (Rubio-Cabetas et al., 1997).
La aplicación de esta técnica en cerezo (Tukey, 1933) permitió aumentar la baja tasa de germinación de las semillas de variedades de maduración precoz de esta especie, pero Blake (1939) fue el primero en aplicarla en un programa de mejora genética de melocotonero. Smith, Bayley y Hugh (Smith et al., 1969) propusieron un protocolo y un medio de cultivo más adaptado al melocotonero (medio SBH), protocolo que a lo largo de los años se ha ido perfeccionando en cuanto a esterilización, medios de cultivo, estratificación, condiciones de cultivo, etc. (Ramming, 1985, 1990; Emershad y Ramming, 1994), y que se analiza paso a paso en el presente artículo.
Esterilización
Con la intención de simplificar el método de esterilización para que fuese menos costoso y no implicara riesgos para los técnicos de laboratorio, Ramming (1990) consiguió un nivel de contaminaciones prácticamente nulo mediante la apertura del fruto y del hueso para la extracción de la semilla (figura 1), y el flameado de la misma dentro de la cabina de flujo laminar tras inmersión en alcohol de 96º. Para evitar el daño del embrión durante el flameado, éste debe hacerse con el extremo micropilar del embrión apuntando hacia el flujo de aire de la cabina (figura 2). Comparaciones de esterilización con lejía comercial a diferentes concentraciones con esterilización por flameado mostraron una eficacia del 100% de embriones no contaminados tanto con lejía al 10% durante 20 minutos como con flameado, obteniendo en ambos casos germinaciones similares (Espiau, 1996). El flameado es una técnica rápida y cómoda, y resulta la más recomendable siempre y cuando se tenga cierta habilidad para no dañar el embrión, y un especial cuidado con el mechero y el alcohol para evitar accidentes de laboratorio.


Medio de cultivo
Una vez realizada la esterilización, el embrión, extraído de la semilla, se inserta en el medio de cultivo, con el micropilo hacia abajo (figura 3).
Aunque siempre se ha considerado que la composición del medio utilizado y el tamaño del embrión son los dos factores determinantes en el porcentaje de plantas germinadas que finalmente sobreviven y son transplantadas a tierra (Ramming, 1985; Sinclair y Byrne, 2003), realmente es más determinante para el porcentaje de germinación el tamaño del embrión que el medio de cultivo (Mansvelt et al, 2015).
Con el medio WPM (Woody Plant Medium; Lloyd y McCown, 1975) se han logrado porcentajes cercanos al 100% de plantas germinadas y una buena supervivencia de las mismas con embriones de entre 5-10 mm., es decir, del 25-50% de ocupación de la semilla (Hamill et al., 2005). Cuando el tamaño del embrión es superior a 10 mm., ocupando al menos el 75% de la semilla, el medio más adecuado parece ser el SBH (Smith et al., 1969).

Estratificación
Comparando la estratificación de embriones maduros de melocotonero a 4 °C durante 15, 30, 45, 60, 75 y 90 días, se obtuvo mayor supervivencia de las plantas cuando la estratificación fue de 60 días (Espiau, 1996). Sin embargo, se observa una tendencia a reducir la temperatura a 1-1,5 °C y los tiempos a 45-60 días (Ramming et al., 2003, Ramming, comunicación personal).
Se ha comprobado que el almacenamiento en frío de los frutos previo a la extracción de la semilla tiene un efecto negativo sobre el crecimiento del embrión, la germinabilidad del mismo y la supervivencia de las plantas tras 3 semanas de almacenamiento de los frutos en frío (Anderson et al., 2006).
Condiciones de cultivo
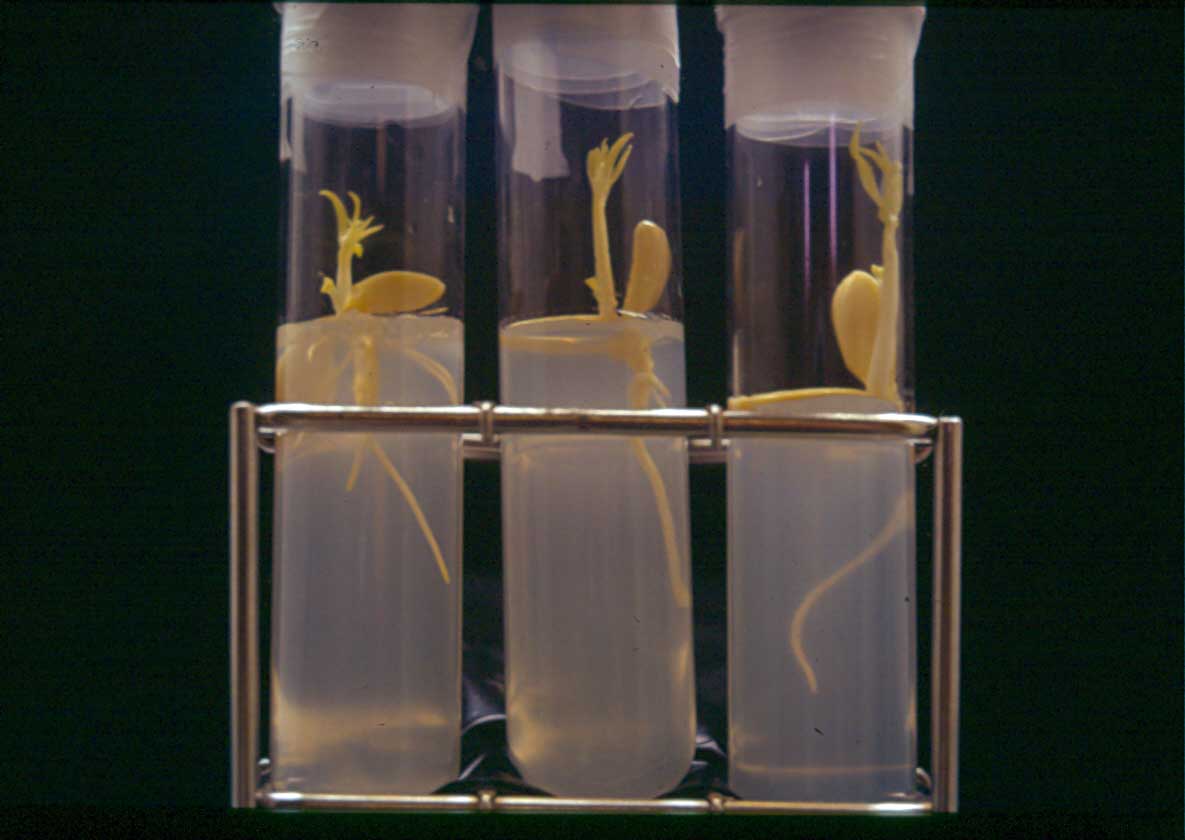
Una vez que han pasado la fase de estratificación, los embriones (figura 4) se transfieren a una cámara de cultivo, habitualmente a 24 ± 2 °C y con fotoperiodo de 12-16 h, aunque, se han observado mejores resultados cuando la temperatura de cultivo se ha disminuido a 20 ± 2 °C, lográndose un aumento de entre un 13 y un 22% en la supervivencia de las plantas una vez implantadas estas condiciones en el programa de mejora (Anderson y Byrne, 2002, Ramming, comunicación personal).
Una vez que la raíz alcanza un tamaño más o menos grande, y antes de que comience a enroscarse dentro del envase de cultivo, las plántulas se transfieren a tierra, requiriendo una progresiva aclimatación de las mismas respecto de las condiciones artificiales a las que ha estado sometido previamente, implantando en este proceso unas condiciones de humedad del 99%.
Cultivo de óvulos
Las variedades extra-tempranas de melocotonero y nectarina alcanzan tamaños de embrión en torno a 1 mm cuando el fruto está maduro. La técnica anteriormente descrita de cultivo de embriones ha resultado inadecuada cuando se trabaja con tamaños tan pequeños (Ramming et al., 2003), lo que sucede con frecuencia cuando se seleccionan parentales de maduración cada vez más temprana.
Para superar este problema, Ramming (1985) combinó la técnica del cultivo de óvulos desarrollada por Stewart y HSU (1977) con el cultivo de embriones para obtener plantas cuando el tamaño del embrión era menor de 5 mm.
La complejidad de la técnica y no tanto la baja germinabilidad han sido los mayores obstáculos para su implantación en algunos programas de mejora.
En los últimos años se han ensayado diferentes medios, tipos de soporte, orientaciones del embrión y tipos de recipiente, resultando en una técnica mucho más sencilla y alcanzando porcentajes del hasta 90% de embriones germinados y transplantados a tierra (Ramming et al., 2003).
Esterilización
Tras eliminar el pedúnculo, los frutos se esterilizan mediante inmersión en etanol al 70% durante un minuto y lavado en hipoclorito de sodio al 0,525% con 0,01% de Tween 20 durante 10 minutos. Los frutos se abren dentro de la cabina de flujo laminar, con tijeras esterilizadas con etanol al 70% (figura 5) (Ramming et al., 2003).

Medio de cultivo y soporte
En este estado, la composición nutritiva del medio de cultivo es de vital importancia, ya que el desarrollo del embrión es heterótrofo y para ello requiere, además, de una fuente más rica en azúcares y vitaminas. Aunque la adición de fitohormonas no ha resultado en un mayor crecimiento del embrión en ningún caso en melocotonero (Pinto et al., 1994), sí se logró una germinabilidad cercana al 100% con una supervivencia del 60% de las plantas germinadas cuando se utilizó el medio SH (Steward y HSU, 1997) suplementado con 6% de sacarosa, 3% de carbón activo y 0,65% de agar (Ramming et al., 2003).
La supervivencia de las plantas germinadas ha sido siempre mayor cuando se ha sembrado el óvulo en orientación vertical, con el micrópilo hacia abajo e introducido en el medio hasta la mitad (Ramming et al., 2003)
Incubación
Los óvulos, una vez en el medio de cultivo (figura 6), son incubados en oscuridad a 27 °C durante 30 días, condiciones en las que los embriones, en el interior, continúan su desarrollo (Ramming et al., 2003).
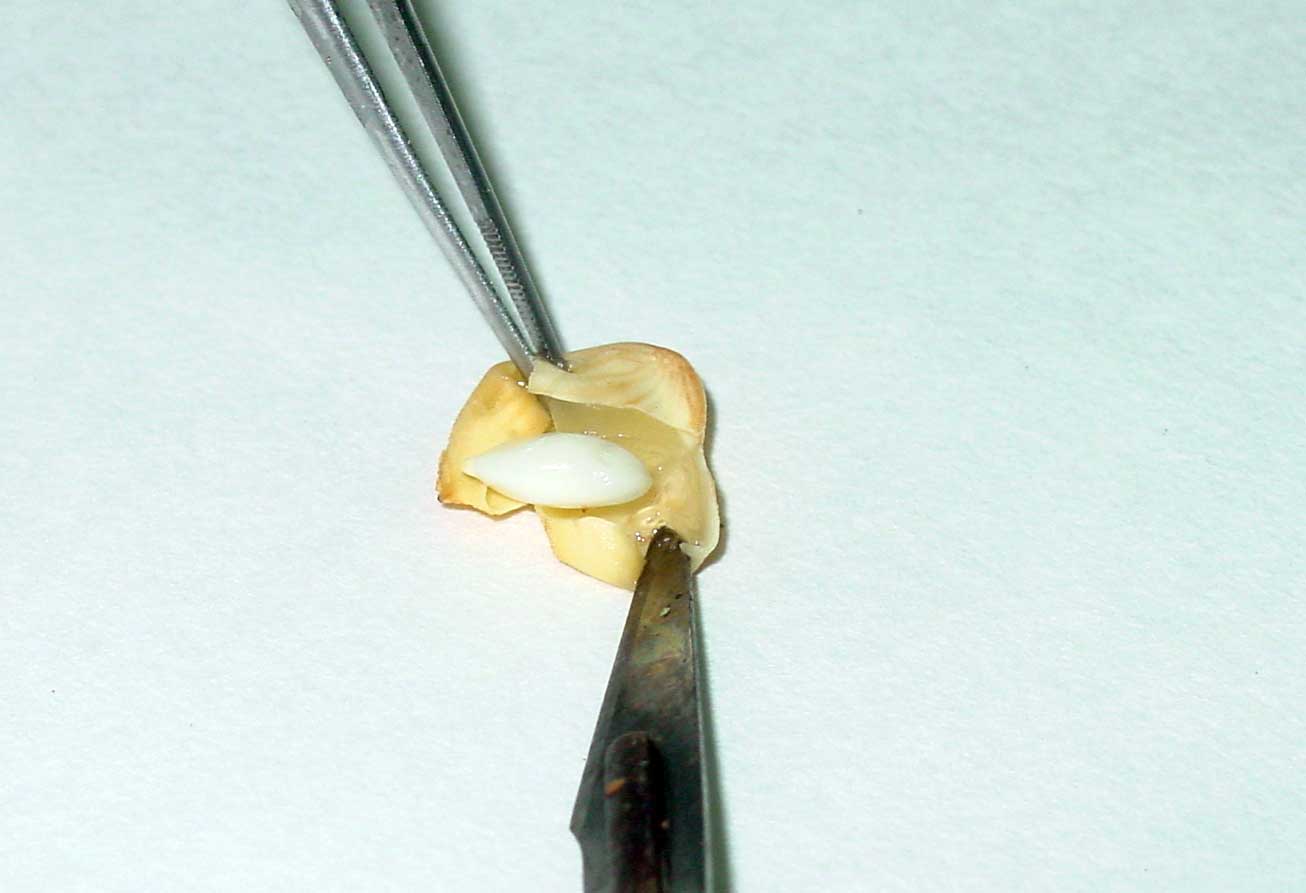
Tras este periodo de incubación, los óvulos se extraen del medio (figura 7), siempre en condiciones asépticas, se abren, y los embriones se transfieren a un medio SBH o WPM, según que el tamaño alcanzado dentro del embrión esté por encima o por debajo de 10 mm. (Rubio-Cabetas et al., 1997, Rubio-Cabetas y Espiau, 2010). A partir de aquí comienza la fase de cultivo de embriones tal y como se ha descrito anteriormente.

Conclusiones
Cuando la maduración tiene lugar antes de 65 días después de la floración (DDF) o el tamaño del embrión no suele superar los 5 mm., se recomienda el uso de los dos pasos siguientes: cultivo de óvulos y posterior cultivo de embriones. Con maduraciones posteriores a los 65 DDF o cuando los embriones superan los 5 mm. de longitud, es suficiente con el cultivo de embriones utilizando el medio WPM. Si la longitud supera los 10 mm, se utilizará un medio más básico, como el SBH.
La técnica conjunta de cultivo de óvulos y de embriones puede ser la solución para la germinación de embriones de un gran número de variedades de bajas necesidades de horas frío, con baja viabilidad de por sí. Esta herramienta, utilizada para variedades tempranas y extra-tempranas de Prunus y algunos híbridos interespecíficos, tiene un claro potencial para programas de mejora.
Referencias bibliográficas
- ANDERSON, N.; BYRNE, D.H., 2002. Cool temperature during germination improves germination and survival of embryo cultured peach seed. Acta Hort. 592, 25-27.
- ANDERSON, N.; BYRNE, D.H.; RAMMING, D.W., 2006. In ovule culture success as affected by sugar source and fruit storage duration for nectarine embryos. Acta Horticulturae. 713:89-92.
- BLAKE, M.A., 1939. Some results of crosses of early ripening varieties of peaches.
- EMERSHAD, R.C.; RAMMING, D.W., 1994. Effects of media on embryo enlargement, germination and plant development in early-ripening genotypes of Prunus growth in vitro. Plant Cell, Tissue and Organ Culture, 37, 55-59.
- ESPIAU, M.T., 1996. Cultivo in vitro de embriones de variedades tempranas de Prunus persica y Prunus avium. Proyecto fin de carrera. Escuela Universitaria Politécnica de Huesca.
- HAMILL, S.D.; BEPPU, K.; TOPP, B.L.; RUSSELL, D.M.; DEFAVERI, J., 2005. Effects of media and fruit ripeness on germination and transplanting of in vitro cultured embryos from low-chill peach and nectarine. Acta Hort. 694, 145-148.
- LLÁCER, G.; ALONSO, J.M.; RUBIO-CABETAS, M.J.; BATLLE, I.; IGLESIAS, I.; VARGAS, F.J.; GARCÍA-BRUNTON, J. and BADENES M.L., 2009. Peach industry in Spain. Journal of the American Pomological Society 63(3):128-133
- LLOYD, G.; McCOWN, B., 1980. Commercially-feasible micropropagation of mountain laurel Kalmia latifolia, by use of shoot tip culture. International Plant Propagators Society, 30: 421-427.
- MANSVELT, E.L., PIETERSE, W.M., SHANGE, S.B.D., MABIYA, T.C., CRONJÉ, C., BALLA, I., HAM, H. and RUBIO-CABETAS, M.J. (2015). Embryo rescue of Prunus persica: medium composition has little influence on germination. Acta Hortic. 1084, 207-210.
- PINTO, A.C.Q.; ROGERS, S.M.D. and BYRNE, D.H., 1994. Growth of immature peach embryos in response to media, ovule support method, and ovule perforation. HortScience 29(9):1081–1083.
- RAMMING, D.W., 1985. In ovulo embryo culture of early maturing Prunus. HortScience, 20, 3, 419-420.
- RAMMING, D.W., 1990. The use of embryo culture in fruit breeding HortScience, 25, 4, 393.
- RAMMING, D. W.; EMERSHAD, R. L.; FOSTER, C., 2003. In vitro factors during ovule culture affect development and conversion of immature peach and nectarine embryos. HortScience 38 (3), 424-428.
- RUBIO-CABETAS, M.J.; SOCIAS i COMPANY, R.; CARRERA, M., 1997. Cultivos de óvulos y embriones en programas de mejora genética en frutales. Fruticultura Profesional 84, 58-68.
- RUBIO-CABETAS, M.J.; ESPIAU, M.T., 2010. Novedades en el cultivo in vitro de embriones y óvulos aplicado a la obtención de variedades tempranas de melocotonero. Revista de Fruticultura. Especial Melocotonero III: 36-41
- SINCLAIR, J.W. and BYRNE, D.H., 2003. Improvement of peach embryo culture through manipulation of carbohydrate source and pH. HortScience 38(4): 582–585.
- SMITH, C.A.; BAYLEY, C.H.; HOUGH, L.F., 1969. Methods for germinating seeds of some species with special reference to growing seedlings from immature embryos N.J. Agr. Expt. Sta. Bu. 823.
- STEWARD, J.M. and HSU, C.L., 1977. In ovulo embryo culture and seedling development of cotton Gossypium hirsutum L. Planta. 137, 2, 113-117.
- TOPP, B.L.; SHERMAN, W.B. and RASEIRA, M.C.B., 2008. Low chill cultivar development. In: The peach, Botany, Production and Uses. Eds. D.R. Layne and D. Bassi.
- TUKEY, H.B., 1933. Embryo abortion in early ripening varieties of Prunus avium. Bot. Gaz.; 94, 433-468.