Se ha estudiado la eficacia de diferentes tratamientos en el control de hongos, principalmente aquellos de reciente introducción (Macrophomina phaseolina y especies de Fusarium) y nematodos
Desinfestación de suelo para el cultivo de la fresa en Huelva: resultados de la campaña 2015-16
El cultivo de la fresa (Fragaria x ananassa Duch.) a nivel mundial en 2013 ocupó más de 360.000 ha, con una producción de más de 7.700.000 t (Faostat, 2016). En la provincia de Huelva se cultivaron durante la campaña 2015/2016 unas 6.250 ha con una producción de 294.650 t. En Europa, concretamente en países mediterráneos del sur, como Italia, Francia o España la desinfestación de suelo es un componente esencial en el cultivo de muchas especies hortícolas entre las que se encuentra la fresa (Chamorro, 2014). El cultivo de fresa para producción de fruto fue el mayor consumidor de bromuro de metilo en España (Lopez-Aranda, 2008) hasta 2006; la eliminación definitiva de dicho fumigante tuvo un impacto importante en el control de hongos patógenos de suelo y otras plagas (López-Aranda, 2013). El Instituto Andaluz de Investigación y Formación Agraria y Pesquera (IFAPA) comenzó en 1997 sus trabajos de experimentación y evaluación de alternativas químicas para la desinfestación de suelos para el cultivo de fresa. Las soluciones que han obtenido buenos resultados han sido adoptadas rápidamente por los productores, como es el caso de la aplicación de la mezcla 1,3-dicloropropeno/cloropicrina, cloropicrina sola o dazomet (Medina-Mínguez et al., 2012). Sin embargo, la actual aplicación del Reglamento (CE) nº 1107/2009, relativo a la comercialización de productos fitosanitarios, hace que la posibilidad de utilización de alguno de estos productos químicos no esté clara en el futuro.
A lo largo de la campaña 2015-16, se ha estudiado la eficacia de diferentes tratamientos en el control de hongos, principalmente aquellos de reciente introducción (Macrophomina phaseolina y especies de Fusarium), y nematodos, así como su influencia en distintos parámetros agronómicos. Los tratamientos incluyen distintos fumigantes y se comparan con un tratamiento de biosolarización, técnica mixta de biofumigación, en este caso con gallinaza, y solarización, cuya eficacia se incrementa con la repetición del tratamiento, año tras año.

Materiales y métodos
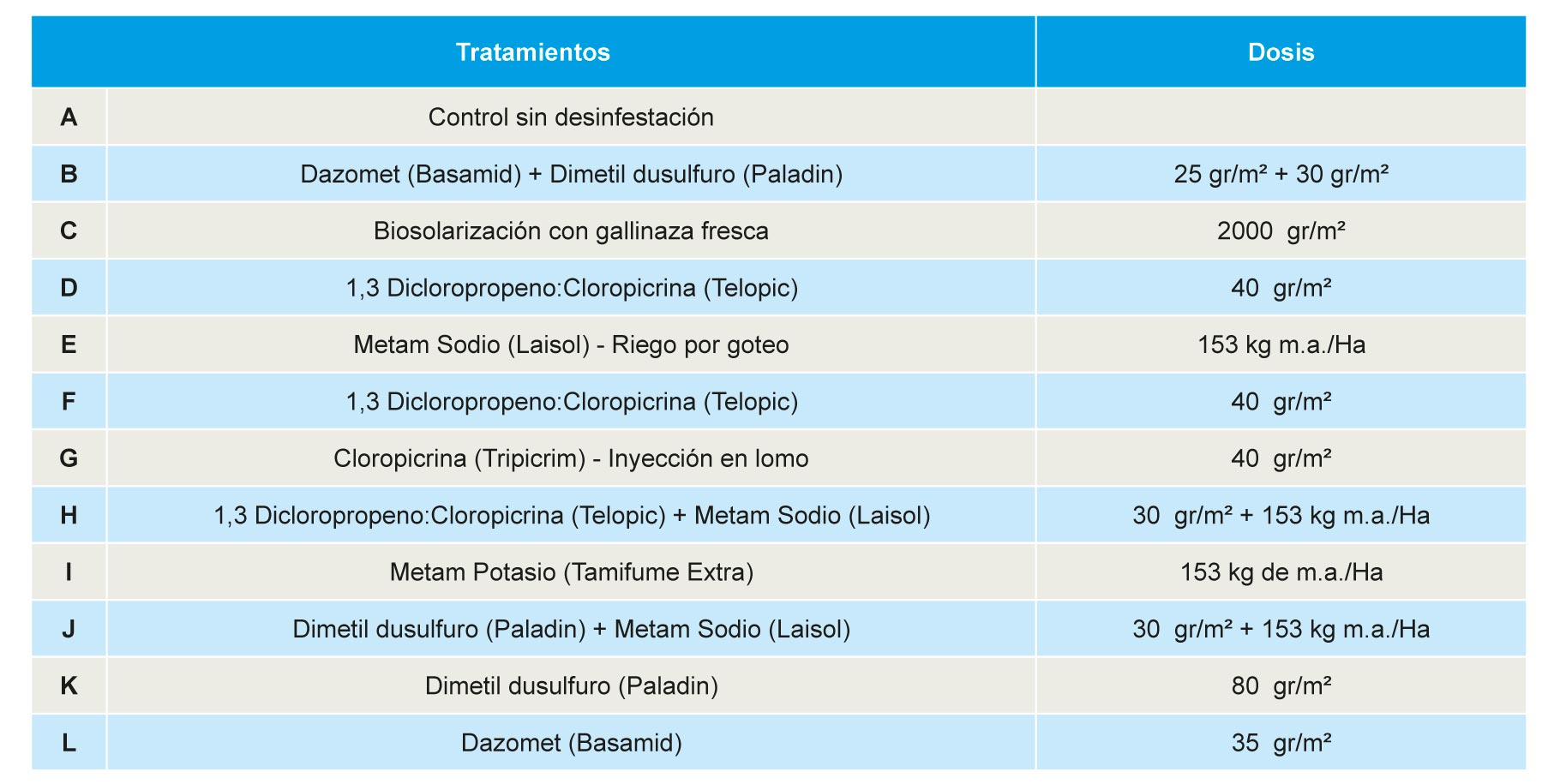
Los ensayos se realizaron en una finca situada en el término municipal de Palos de la Frontera, perteneciente a la empresa Fres-Gómez SL (lat. 37º14´N, long. 6º53´W). El suelo de la parcela de ensayo es arenoso con un contenido en materia orgánica entre 0,5% y 0,75% y un pH entre 6.7 y 7.1. Estos suelos no han sido desinfestados con bromuro de metilo u otro desinfestante químico desde 2008, fecha desde la que se superponen tratamientos de similares características en cada parcela elemental. El estudio actual se plantea sobre un diseño experimental de bloques al azar con 3 repeticiones y un tamaño de la parcela elemental de 80 m2. Los tratamientos ensayados se describen en la Tabla 1.
Los tratamientos fueron aplicados como se detalla a continuación: el tratamiento B (Dazomet + DMDS), consistió en la aplicación a toda superficie de Basamid, que fue incorporado mediante Mixtiller PE, seguido de la aplicación de Paladin por inyección en lomo bajo plástico DAF (plástico impermeable a DMDS). El tratamiento C (biosolarización) se inició a mediados de julio de 2015, mediante la incorporación con rotovator de gallinaza a toda superficie, riego a capacidad de campo y la cubierta con plástico transparente LDPE (polietileno de baja densidad) (50µm), que fue retirado a mediados del mes de agosto. Los tratamientos D, E, H, I y J se aplicaron a través del riego por goteo una vez conformado el lomo de cultivo; en todos los casos se utilizó como plástico de acolchado polietileno normal negro, excepto en el caso del tratamiento J, dónde se utilizó plástico DAF. Los tratamientos F, G y K se aplicaron mediante inyección en lomo, los dos primeros bajo polietileno normal negro y el último bajo plástico DAF. Por último, la aplicación de Basamid en el tratamiento L se realizó de la misma forma que en el B.

Para determinar la eficacia de los tratamientos en el control de nematodos y hongos de suelo se tomaron muestras de suelo antes de la aplicación (18 de agosto, 2015) y después de la aplicación de los tratamientos (15 de octubre, 2015).
La plantación se realizó el 14 de octubre de 2015, con plantas de fresa de la variedad 'Florida-Fortuna', procedente de viveros de altura (Viveros Gardisancho, Niharra (Ávila)). La cubierta plástica (polietileno térmico, nuevo, de 150 µm de espesor) en los macrotúneles se instaló el 10 de noviembre de 2015.
Se analizaron los siguientes parámetros:
- Vigor de la planta, mediante mediciones mensuales (desde diciembre 2015 a abril 2016) del diámetro de la parte aérea de diez plantas por parcela elemental. Esta medida se realizó con la ayuda de una forcípula que permite conocer el diámetro ecuatorial de la parte aérea de la planta. Se realizó tomando como referencia el diámetro en el sentido perpendicular al eje del lomo de cultivo.
- Producción comercial: Registrada a lo largo de todo el período de producción (enero-mayo de 2016). Se separa en 1ª y 2ª categoría.
- Análisis de suelo antes / después de los tratamientos.
- Mortalidad: a lo largo del periodo de cultivo, desde finales de octubre 2015 hasta principios de junio 2016 se procedió al conteo de plantas muertas. Hasta mediados de mayo 2016, se recogieron plantas sintomáticas en las distintas parcelas elementales y se realizaron aislamientos de tejido para determinar el agente causal.
- Análisis de plantas asintomáticas, a final de campaña, para determinar la severidad de la enfermedad causada por nematodos. Se analizaron cinco de las diez plantas sobre las que se realizó el seguimiento de vigor a lo largo de la campaña.
La recogida de muestras del suelo se realizó con una sonda vertical graduada (0 a 20 cm de profundidad), en cada una de las parcelas elementales, en dos momentos:
- Antes de la aplicación de los tratamientos (pre-tratamiento).
- Un mes después de la aplicación de los tratamientos (post-tratamiento).
Antes de la aplicación de los tratamientos, la toma de muestras en parcelas tratadas a toda superficie se realizó en zigzag. En el caso de tratamientos aplicados a lomo, las muestras se tomaron del lomo central. Después de la aplicación de los tratamientos, todas las muestras se tomaron del lomo central.
Para determinar el estado sanitario de las plantas de fresa utilizadas en este estudio, antes de la plantación se realizó un muestreo estratificado del material procedente de viveros de altura. Posteriormente, coincidiendo con la aparición de plantas sintomáticas se tomaron muestras al azar, en las distintas parcelas experimentales.
Procesamiento de muestras - nematodos
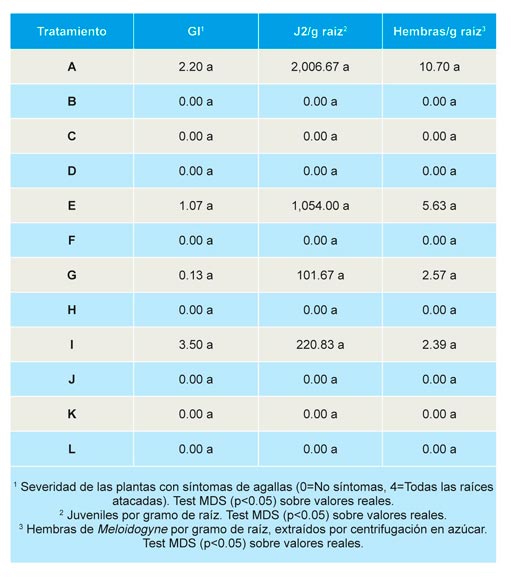
Tras finalizar la campaña se recolectaron, en cada parcela 5 plantas con su sistema radicular completo, elegidas entre las 10 a las que se les había hecho seguimiento agronómico y el cálculo del vigor durante el cultivo. A cada planta se le realizó un análisis visual de las raíces para detectar la presencia de nódulos causados por Meloidogyne hapla, valorando su severidad en una escala (0 = planta sana a 4 = todas las raíces atacadas). A continuación, las raíces de las 5 plantas se juntaron en una muestra de 10 g representativa de cada parcela, y se efectuó una extracción de las hembras de Meloidogyne hapla y de los individuos de Pratylenchus por el método de centrifugación en azúcar (Talavera, 2011).

Procesamiento de muestras - hongos
- Aislamiento de hongos patógenos a partir de suelo: La metodología seguida para aislamiento de suelo de M. phaseolina es una modificación de la utilizada por Papavizas y Clark (1974). Las muestras de suelo se dejaron secar a temperatura ambiente, de cada muestra se pesaron 10 gramos de suelo, que se vertieron en una solución de 225 ml de H2O destilada estéril a la que añadimos 25 ml de hipoclorito sódico (NaOCl) al 1%. Se batió el suelo durante 30 segundos dejando reposar durante 3 minutos, en tres ciclos. El concentrado se tamizó con una criba, 0,49µm de apertura de malla. El suelo retenido en la malla se lavó con agua corriente, para eliminar posibles restos de NaOCl, se vertió en 100 ml de H2O destilada estéril. A continuación se tomaron 5 alícuotas de 1 ml, que se extendieron en la superficie de las placas Petri, conteniendo el medio de cultivo PDA-DOPCNB, realizándose 5 repeticiones por muestra. Las placas se mantuvieron en oscuridad a 27 °C durante 7 días, momento en el que se evaluó el número de colonias de M. phaseolina. Para el aislamiento de especies de Fusarium, se realizaron diluciones seriadas y un medio agarificado semiselectivo (Leslie y Summerell, 2006).
- Aislamiento de hongos patógenos a partir de tejido afectado en plantas: Las muestras se procesaron en el laboratorio. Se realizaron aislamientos de tejidos para determinar la presencia de hongos patógenos. Los tejidos vegetales fueron previamente lavados en agua corriente y sumergidos en hipoclorito sódico al 6,75% durante un minuto, posteriormente lavados dos veces en agua destilada estéril. Cortes de tejido de 3 a 5 mm se introdujeron en hipoclorito sódico al 2% durante 30 segundos, lavándose en agua destilada estéril y dejándose secar. A continuación, los cortes se dispusieron en placas Petri, medio agar-patata-dextrosa (PDA, DIFCO) al que se le añadieron 2 g/l de extracto de levadura y 0,05 g/ l de estreptomicina. Las placas se mantuvieron en cámara de cultivo microbiológica (Cámara Universal Economic, ASL) durante siete días a 25 °C y en oscuridad. Los patógenos se identificaron por sus características morfológicas mediante microscopía óptica (Nikon-ECLIPSE-E600).
Análisis estadístico
Resultados
Vigor
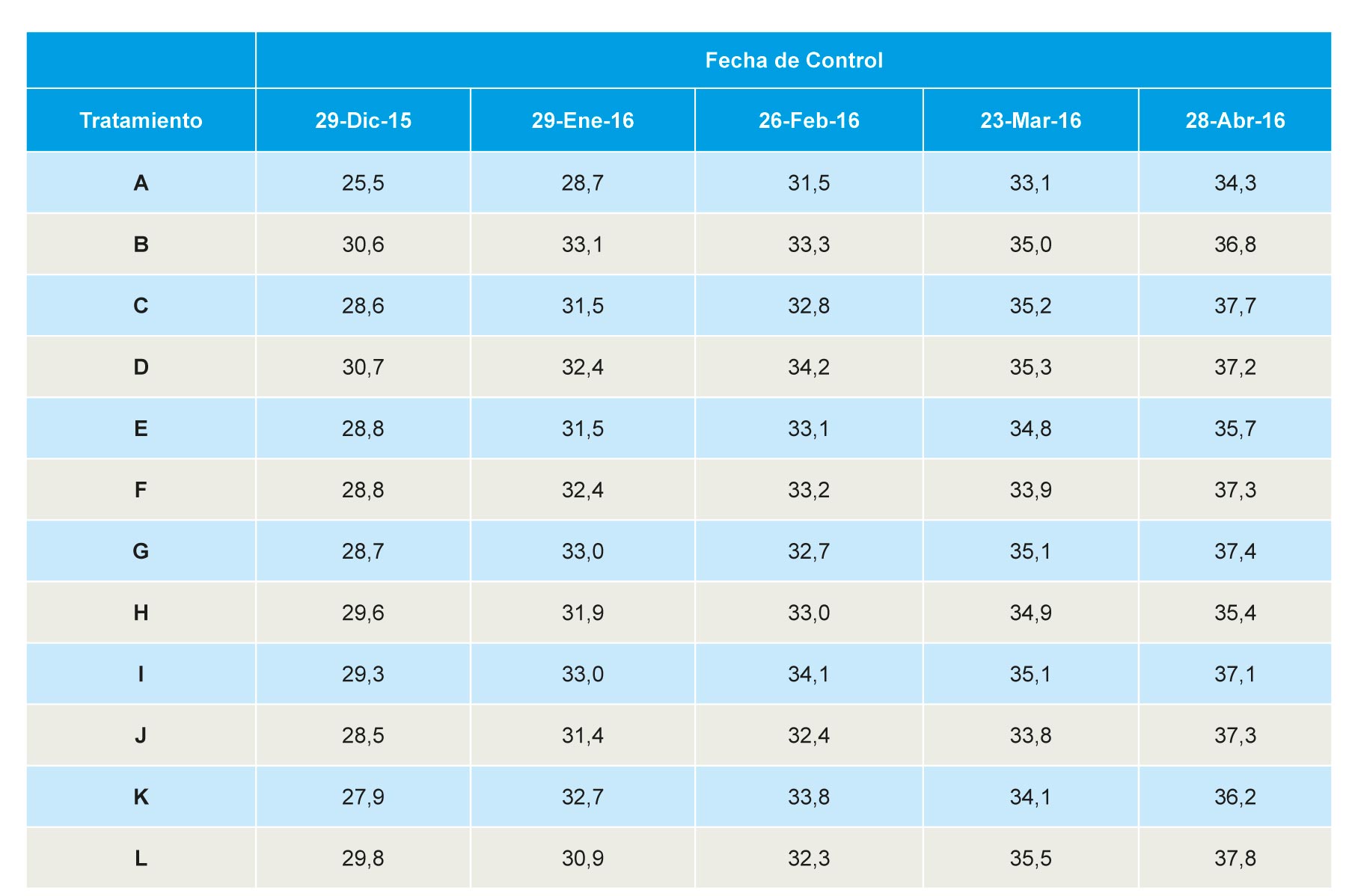
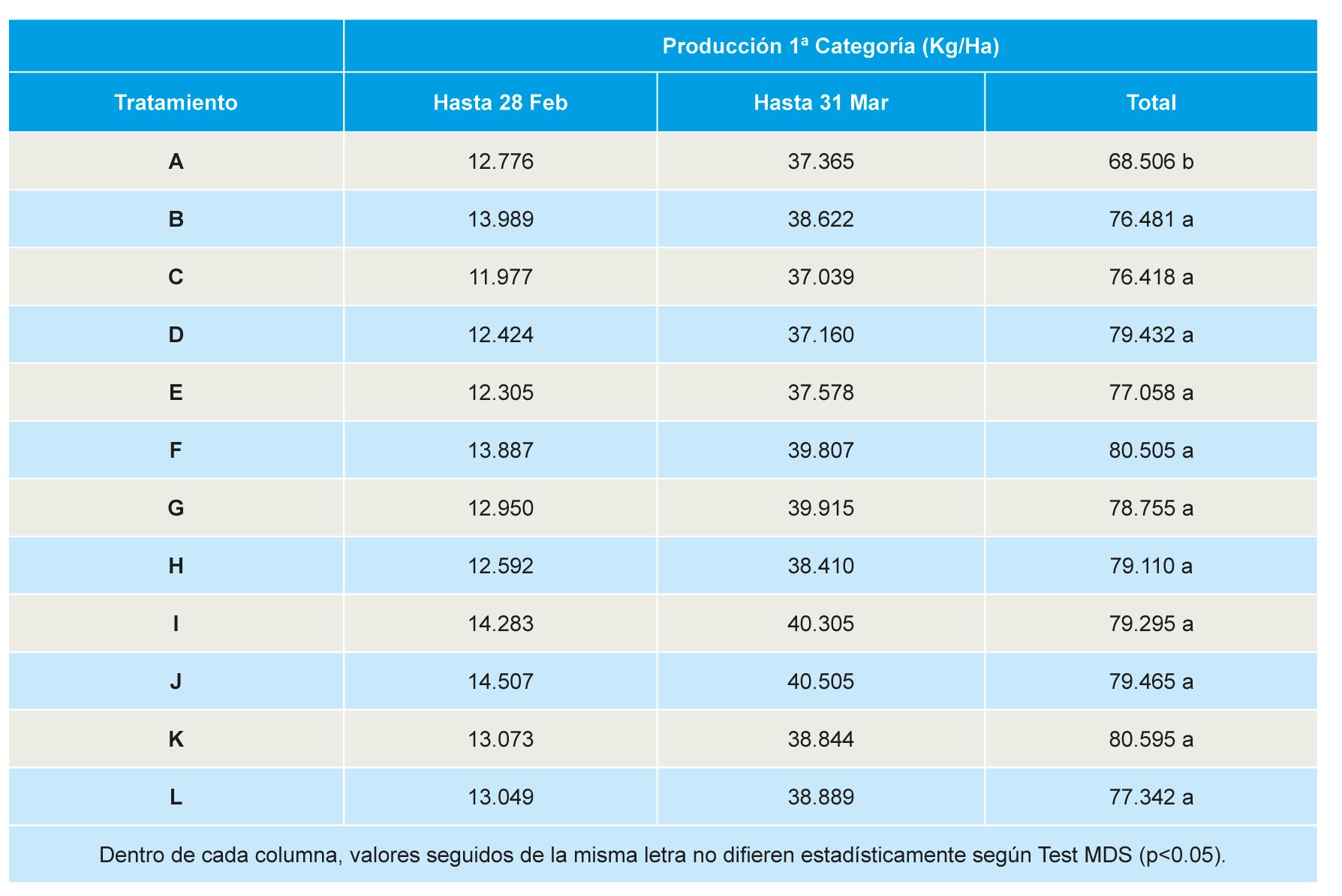
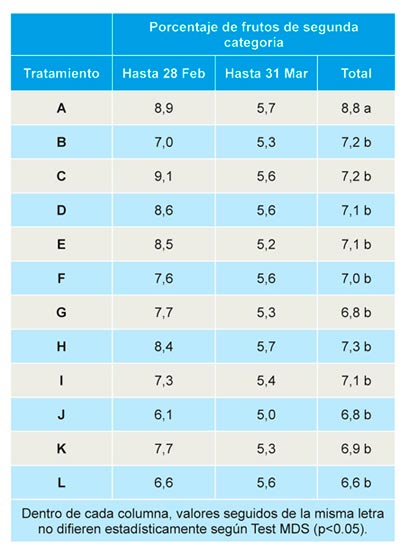
Producción comercial
No se observaron diferencias significativas entre tratamientos en la producción de fruta de primera categoría en producción extra-precoz (hasta finales de febrero) y precoz (hasta finales de marzo). Sin embargo, al analizar la producción total (acumulada hasta final de campaña), se observó un rendimiento significativamente inferior en parcelas correspondientes a suelos no tratados, no detectándose diferencias significativas entre el resto de tratamientos (Tabla 3).
Eficacia de los tratamientos en el control de nematodos
Se encontró Meloidogyne hapla en todas las parcelas en algún momento del ciclo. Hemicycliophora apareció en 11 de las 36 de las parcelas muestreadas en un rango de densidades entre 6 y 210 nematodos por 250 g de suelo. No se detectó la presencia de Pratylenchus penetrans.
Todos los tratamientos resultaron efectivos en la reducción de densidades de M. hapla en suelo (Tabla 5), ya que en el único tratamiento en el que no se redujeron las densidades de forma significativa fue en el control sin desinfestación. No obstante, los tratamientos E, G e I fueron menos eficaces que el resto en la reducción de las densidades de nematodos en suelo.
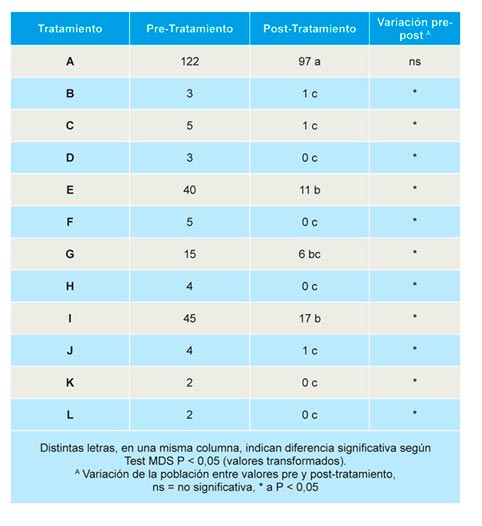
No se encontraron diferencias significativas en la incidencia y severidad de la enfermedad causada por M. hapla en plantas de fresa al final de la campaña (Tabla 6). Aunque, en los controles sin desinfesción y en los tratamientos E, G e I, las densidades de M. hapla son mayores que en el resto de tratamientos, no se observaron diferencias significativas entre ellos.
Eficacia de los tratamientos en el control de hongos patógenos de suelo
Estado sanitario de las plantas de fresa en pre-plantación: En los tejidos de las plantas procedentes del muestreo realizado antes de la plantación no se detectó M. phaseolina, aunque si se aislaron especies de Fusarium, Cylindrocarpon, Rhizoctonia y Phoma.
Eficacia de los tratamientos en el control de hongos patógenos de suelo: Se determinó la eficacia de los tratamientos en el control de hongos patógenos de suelo mediante la cuantificación de la población de Macrophomina phaseolina y Fusarium spp. en las muestras tomadas antes y después de la aplicación de los mismos.
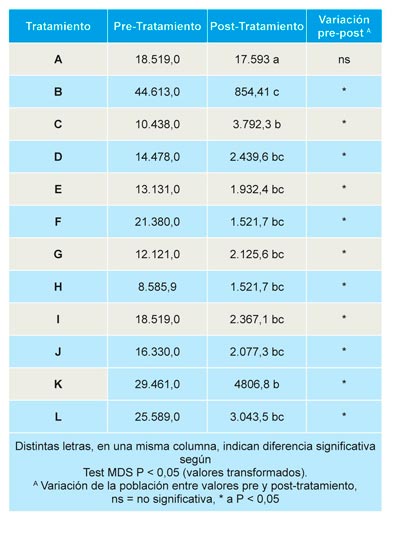
M. phaseolina: antes de la aplicación de los tratamientos el número de esclerocios de M. phaseolina por gramo de suelo osciló entre 0 y 2, no detectándose el patógeno en parcelas correspondientes a los tratamientos H y J (Tabla 7). Todos los tratamientos redujeron de forma significativa respecto al control la población de M. phaseolina en suelo; aunque se detectó un incremento no significativo de la población, con respecto a la inicial, en los suelos de parcelas correspondientes a los tratamientos E, F, G, H y K (Tabla 7).
Fusarium spp.: Antes de la aplicación de los tratamientos, no se observaron diferencias significativas en el número medio de unidades formadoras de colonias (UFC) de especies de Fusarium por gramo de suelo, lo que indica que la población se distribuye de forma homogénea en la parcela experimental. Los tratamientos redujeron de forma significativa, respecto al control, la población de Fusarium spp., siendo significativa la reducción, respecto a la población inicial, en todos los suelos tratados, no así en el caso del control no tratado (Tabla 8).
Efecto de los tratamientos en la incidencia de enfermedades fúngicas (mortalidad)
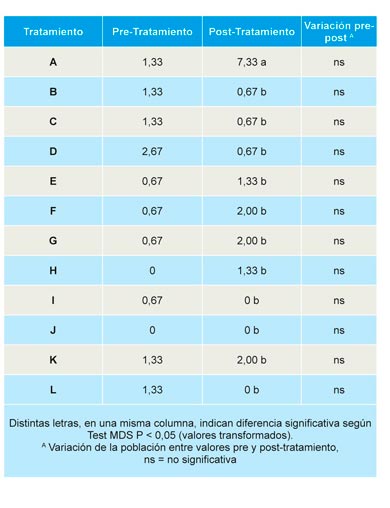
Para determinar la incidencia de plantas muertas se realizaron ocho controles a lo largo de la campaña agrícola, el primero el 23 de octubre de 2015 y el último el 1 de junio de 2016. A partir del muestreo del 11 de Mayo de 2016, se aprecia que el testigo muestra un número de plantas muertas claramente superior a los demás tratamientos, siendo significativa esta diferencia solo en el último control, con un 29,8% de plantas muertas en las parcelas testigo (Tabla 9). Sobre estas plantas muertas se procedió a realizar el análisis patológico oportuno con el objeto de conocer el hongo patógeno, agente causal de la enfermedad.
De las primeras plantas muertas, recogidas a finales de octubre de 2015, se aislaron, de forma mayoritaria, especies de Phoma, Fusarium y los agentes causales de podredumbre negra de raíz (BRR) (Cylindrocarpon, Rhizoctonia y Pythium spp.), sin diferencias significativas entre tratamientos. En esta fecha, se detectó M. phaseolina en una planta procedente del tratamiento B, así como Pestalotiopsis clavispora, en otra planta procedente de suelos tratados con TELOPIC (40), tratamiento D. No se volvieron a observar plantas muertas hasta finales de febrero de 2016 (Tabla 9).
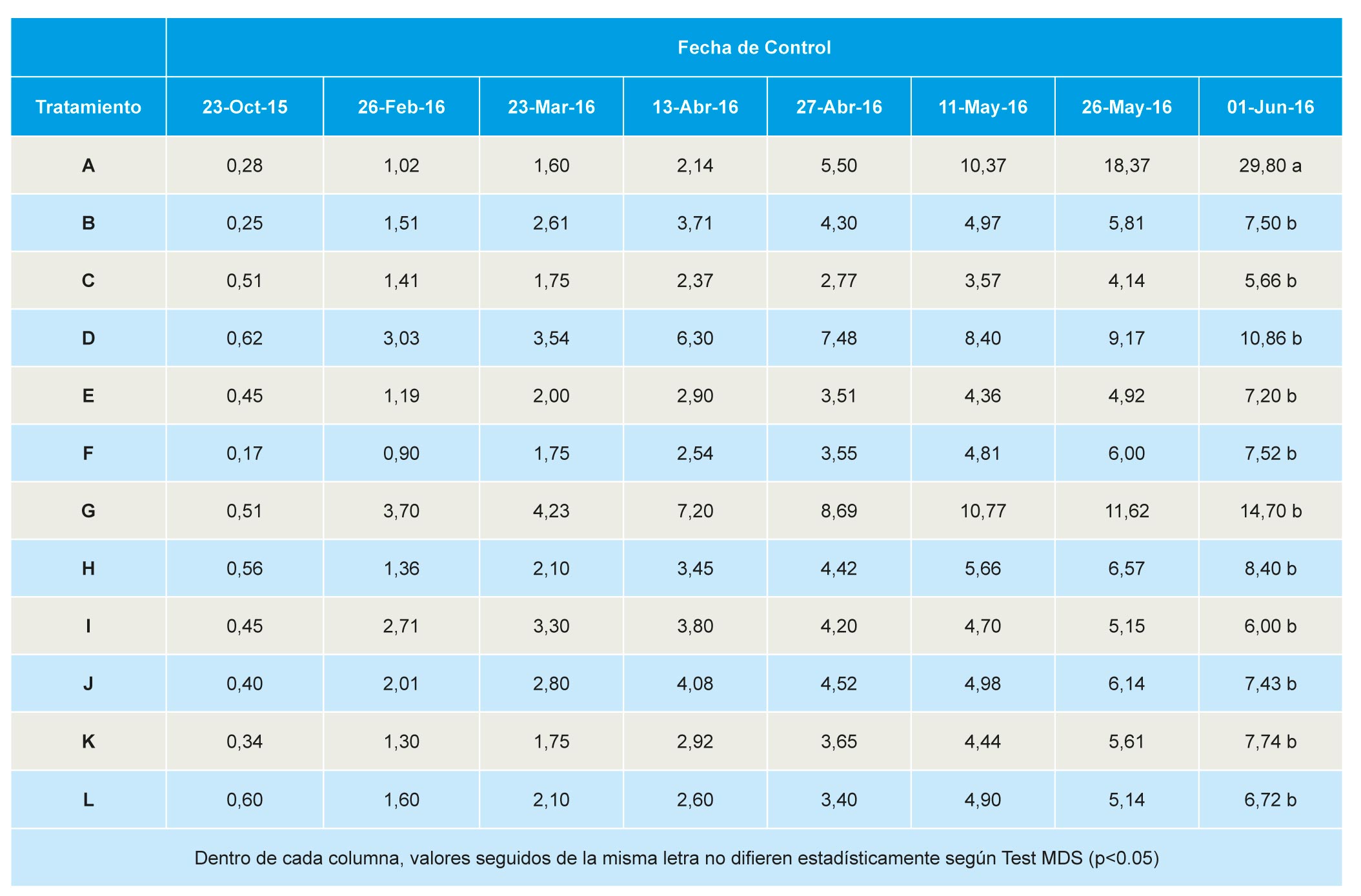
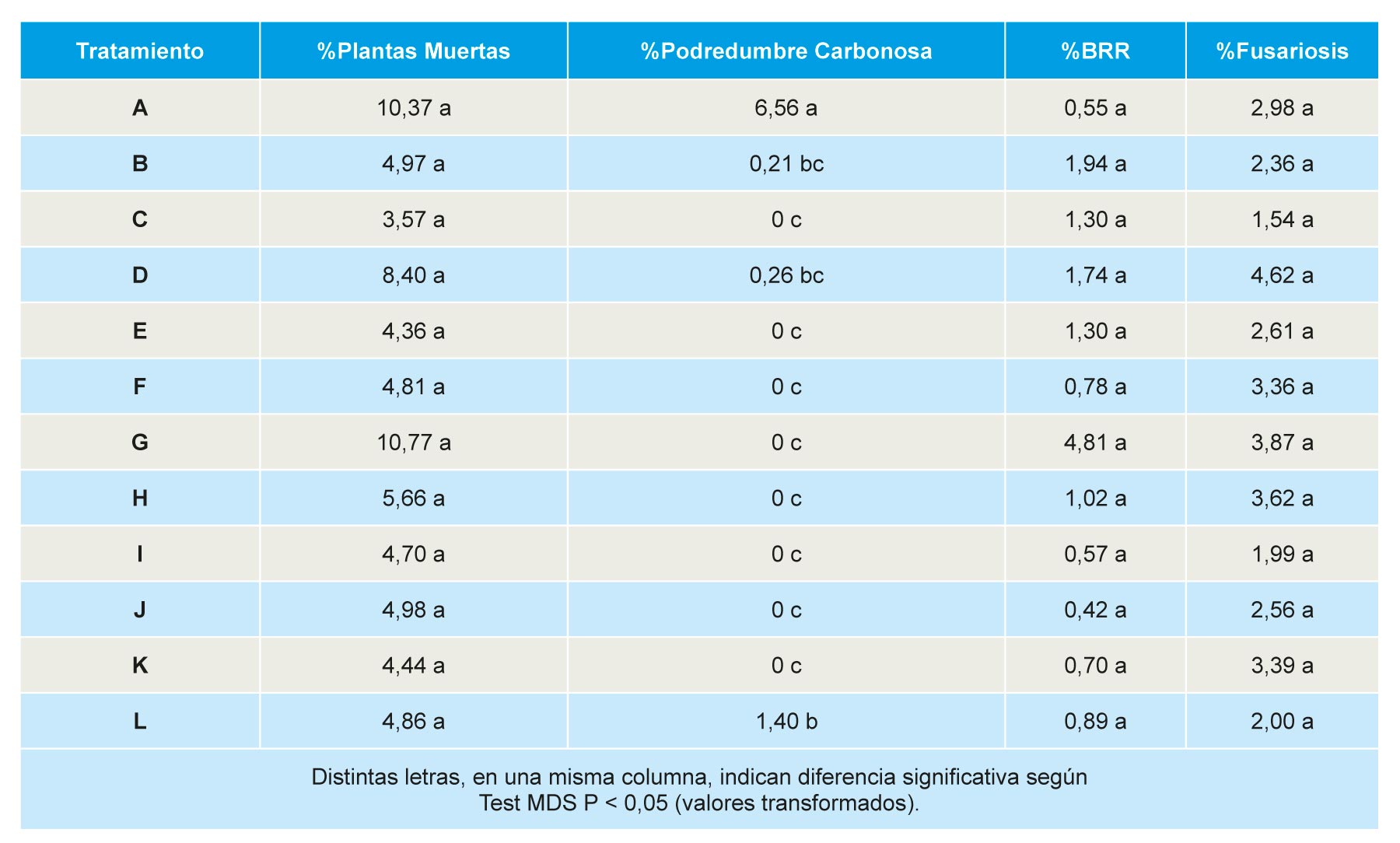
No se observaron diferencias significativas en la mortalidad acumulada hasta el 11 de mayo de 2016, la ausencia de significación se debe al amplio rango en las parcelas control, con un mínimo de 2% y un máximo de 17% de plantas muertas. Todos los tratamientos redujeron de forma significativa respecto al control la incidencia de podredumbre carbonosa (agente causal M. phaseolina), detectándose solo plantas afectadas en las parcelas tratadas con Dazomet DMDS(B), Telocopic 40 (D) y Dazomet (L). La incidencia de podredumbre negra de raíces (BRR) varió entre el 1,94% en parcelas tratadas con Dazomet DMDS (L) y 0,42% en parcelas tratadas con DMDS Metam-Na (J). La incidencia de fusariosis (ocasionada por especies de Fusarium), varió entre 4,62% en parcelas tratadas con TELOPIC (40) LPDE (D) y el 2% en las tratadas con Metam potasio (I) o Dazomet (L), sin diferencias significativas entre tratamientos (Tabla 10).
Referencias bibliográficas
- Chamorro, M. 2014. Evaluación de la eficiencia de tratamientos de desinfesción de suelo en el control de Macrophomina phaseolina, agente causal de podredumbre carbonosa en fresa. Tesis Doctoral. Universidad de Sevilla (España).
- http://faostat.fao.org, 2016. The Online Database Published by FAO - Food and Agriculture Organization of the United Nations.
- Leslie, J.F. y Summerell, B.A. 2006. The Fusarium Laboratory Manual, Blackwell Publishing, 388 pp.
- López-Aranda, J.M. 2008. EL cultivo de la fresa en Huelva. En: La fresa de Huelva. Junta de Andalucía (ed). Ideas, Exclusivas y Publicidad S.L., Sevilla (España). pp. 101-174.
- López-Aranda, J.M. 2013. Agricultural production in the EU, five years after the end of methyl bromide: problems and solutions. 2013. Annual International Research Conference on Methyl Bromide Alternatives and Emissions Reductions. San Diego, California, USA, November 4, 2013.
- Medina-Mínguez, J.J., Miranda, L., Domínguez. P., Soria, C., Pérez-Jiménez, R.M., Zea, T., Talavera, M., Velasco, L., Romero, F., Delos Santos, B. y López-Aranda, J.M. 2012. Comparison of different chemical and non-chemical alternatives to methyl bromide for strawberry in Huelva (Spain). J Berry Res 2:113–121. doi:10.3233/JBR-2012-032.
- Papavizas, G. y Klag, N.G. 1975. Isolation and quantitative determination of Macrophomina phaseolina from soil. Phytopathology 65: 182-187
- Talavera, M. 2011. Detección, extracción y diagnóstico de nematodos fitoparásitos. En: Enfermedades causadas por nematodos fitoparásitos en España. SEF-Phytoma. Madrid. Pp. 41-59.

