Análisis de las diferentes fases y sus características
Fisiología del cuajado en los cítricos: factores endógenos nutricionales y hormonales
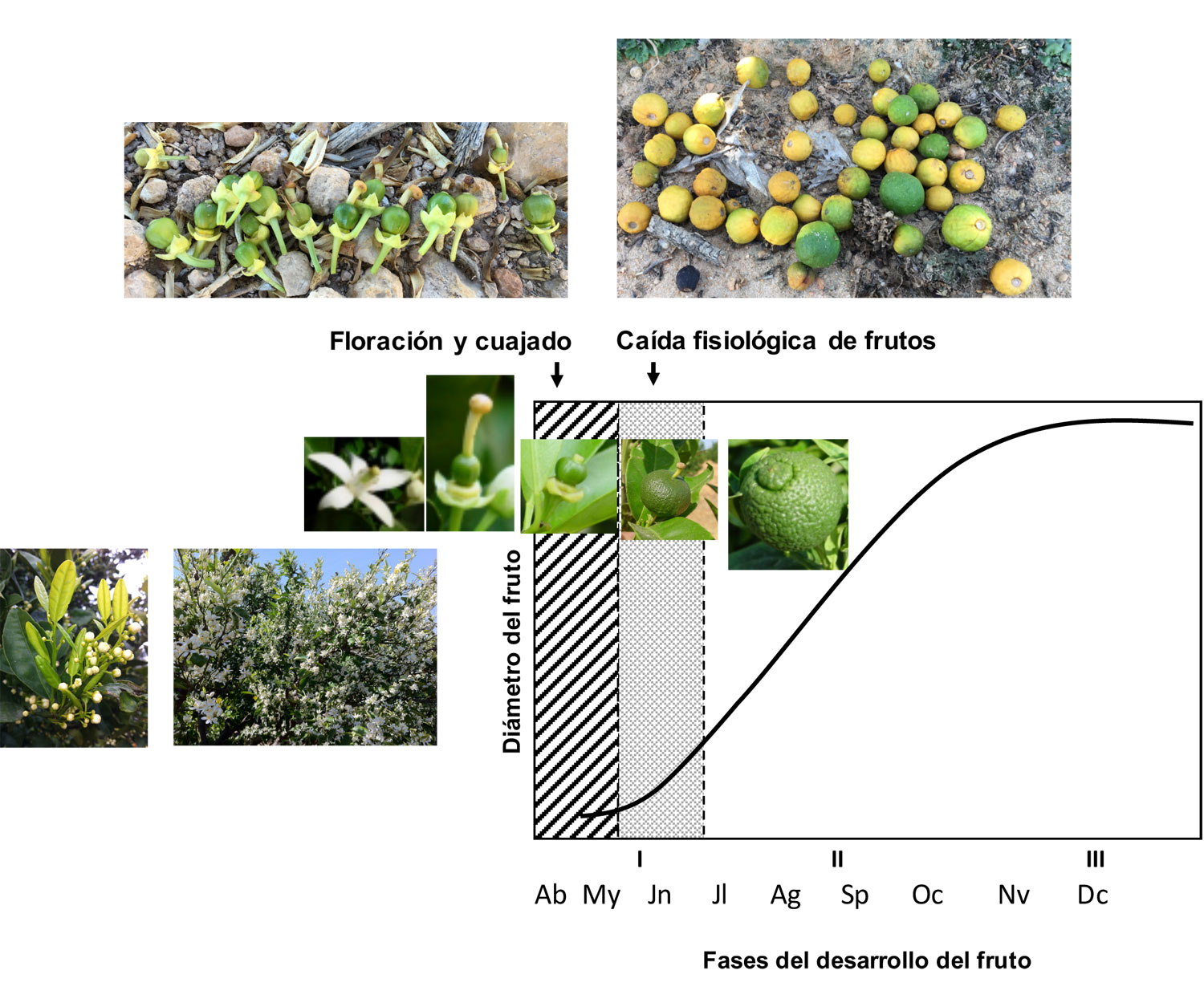
El proceso de cuajado es la transición del ovario de la flor a fruto en desarrollo, y sucede a los pocos días de la apertura floral o antesis. En los cítricos, el ovario comienza su desarrollo tras la polinización de la flor y la fecundación del óvulo o, en su ausencia, a través de la partenocarpia. Tras el cuajado, se inicia la fase I del desarrollo del fruto, durante la cual se produce la caída de un alto porcentaje de los frutos que han iniciado el desarrollo, llamada caída fisiológica de frutos o caída de junio, de manera que todos los frutos que alcanzan la fase II continúan su desarrollo hasta la maduración (Figura 1). Así´ pues, la fase I tiene lugar desde la antesis hasta el final de la caída fisiológica de frutos, y se caracteriza por un rápido crecimiento del fruto provocado por la división celular, en la que los carbohidratos son consumidos para nutrir los procesos de duplicación del material genético y la citocinesis, de gran demanda energética. Debido a un fenómeno de competencia entre los ovarios en desarrollo, aquellos mejor situados en el árbol (en brotes con hojas jóvenes) tendrán un mayor aporte nutricional y hormonal y, por tanto, tendrán más probabilidades de cuajar. La competencia por carbohidratos es la causa principal de la caída de frutos en desarrollo. Las giberelinas son las hormonas más importantes durante esta fase, estando también implicadas las citoquininas, las auxinas, el ácido abscísico y el etileno. Cuanto mayor es la capacidad de cada variedad para sintetizar giberelinas en las paredes del ovario, mayor es su capacidad de crecimiento y, por tanto, de cuajado partenocárpico.

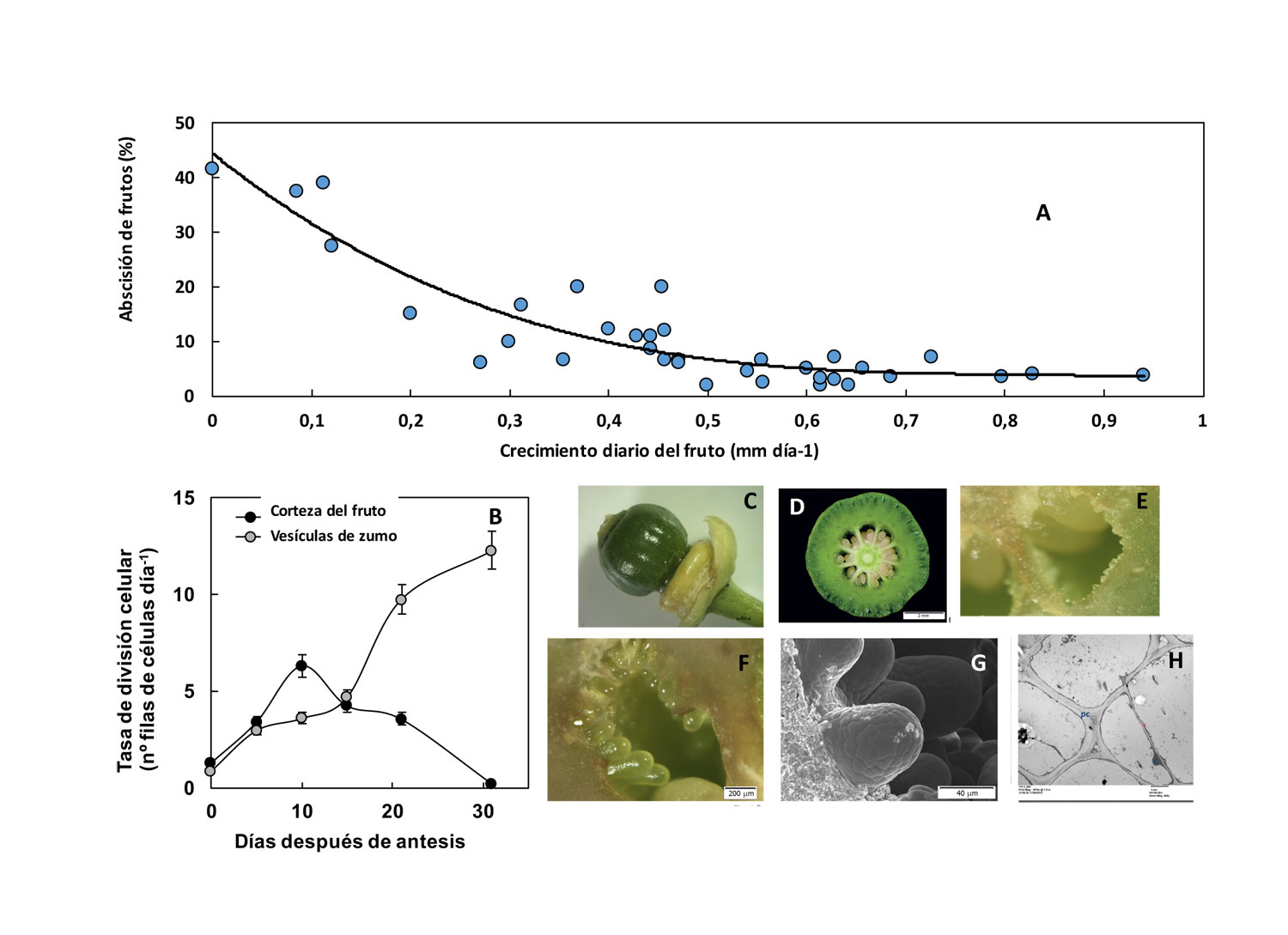
La tasa de división celular condiciona el desarrollo del ovario y el cuajado
La competencia por carbohidratos
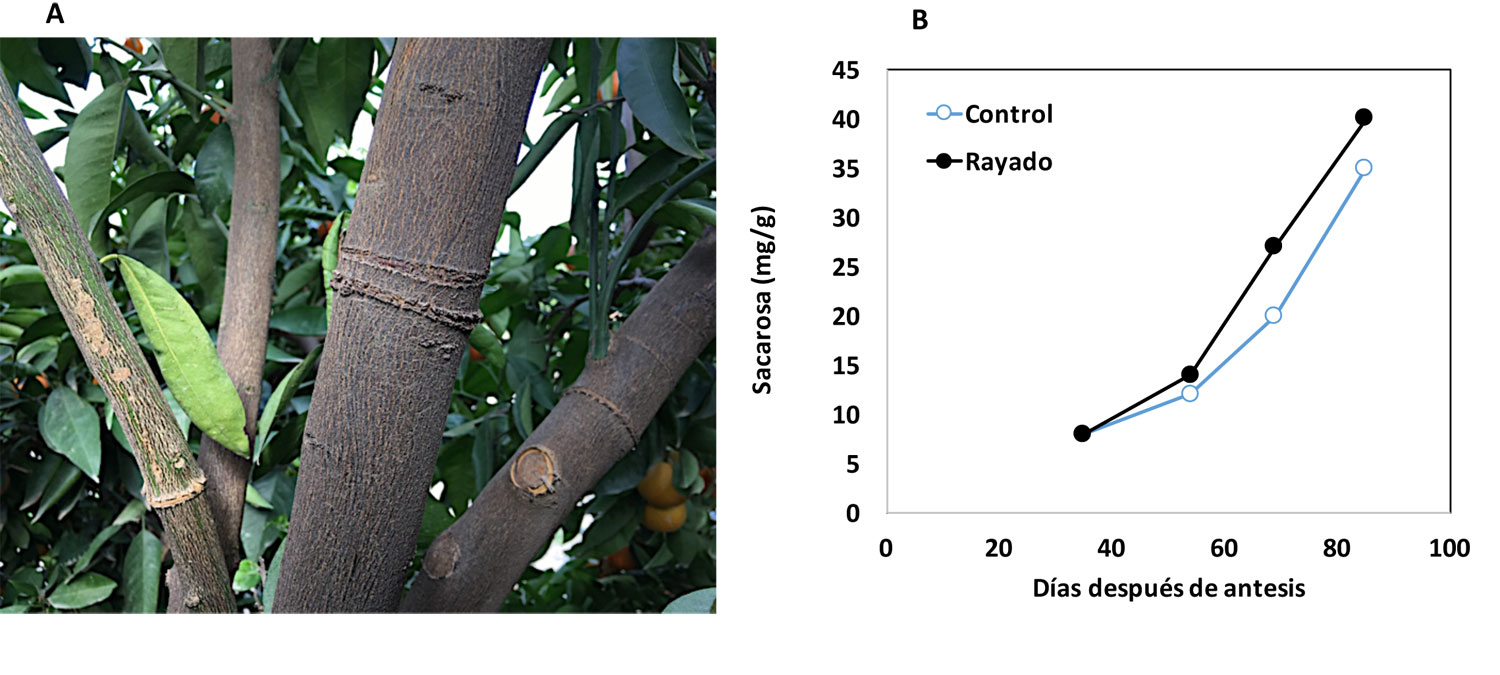
Por tanto, la competencia por nutrientes durante el desarrollo del ovario es uno de los factores limitantes del cuajado. El fruto es el órgano sumidero más importante y reclama gran cantidad de los carbohidratos disponibles en el árbol durante su desarrollo, limitando mientras crece el desarrollo vegetativo (Mehouachi et al., 1995; Martínez-Alcántara et al., 2015). En este sentido, la presencia de hojas juega un papel determinante debido a su capacidad para sintetizar y exportar metabolitos al fruto en desarrollo. Durante el desarrollo inicial del brote las hojas actúan como sumidero de nutrientes, importándolos de otras partes de la planta y compitiendo, por tanto, con los ovarios; pero a medida que éstas maduran su papel se invierte, llegando a convertirse en fuente de carbohidratos al inicio de la fase de elongación celular (20-30 días después de antesis), y confiriendo al brote autosuficiencia para desarrollar el fruto (Rivas et al., 2007). Es por ello que los frutos situados en mejor posición, esto es, en brotes con hojas jóvenes, tienen mayor persistencia en el árbol que aquellos situados en brotes sin hojas jóvenes, más propensos a la abscisión debido a la menor disponibilidad de carbohidratos a su alcance durante el desarrollo inicial.
Pero mientras la defoliación durante la caída fisiológica de frutos reduce el contenido en carbohidratos de los frutos y de los tejidos de reserva de la rama, la defoliación durante la antesis no lo hizo (Mehouachi et al., 1995). Ello sugiere que los carbohidratos almacenados en el ovario de la flor en el momento de la antesis pueden provenir o de su capacidad para generar reservas o, por el contrario, de su capacidad fotosintética. El almidón es el carbohidrato de reserva más importante en los órganos vegetales y su acumulación en el pistilo de la flor ha sido demostrada en diversas especies leñosas, especialmente en las caducifolias (Rodrigo et al., 1999). Mehouachi et al. (1995) demostraron que en la mandarina Satsuma existe también acumulación de almidón en el ovario de la flor previa al cuajado, y posteriormente, Mesejo et al. (2013) observaron un mayor contenido de almidón en el ovario de la mandarina ‘Marisol’ que en el de la mandarina ‘Clemenules’, que presentan alta y baja capacidad de cuajado, respectivamente. El contenido de almidón presente en el pistilo en el momento de la antesis podría ser determinante para el éxito del cuajado del fruto, pero su papel está por determinar.
Las giberelinas y su relación con la división celular y el cuajado
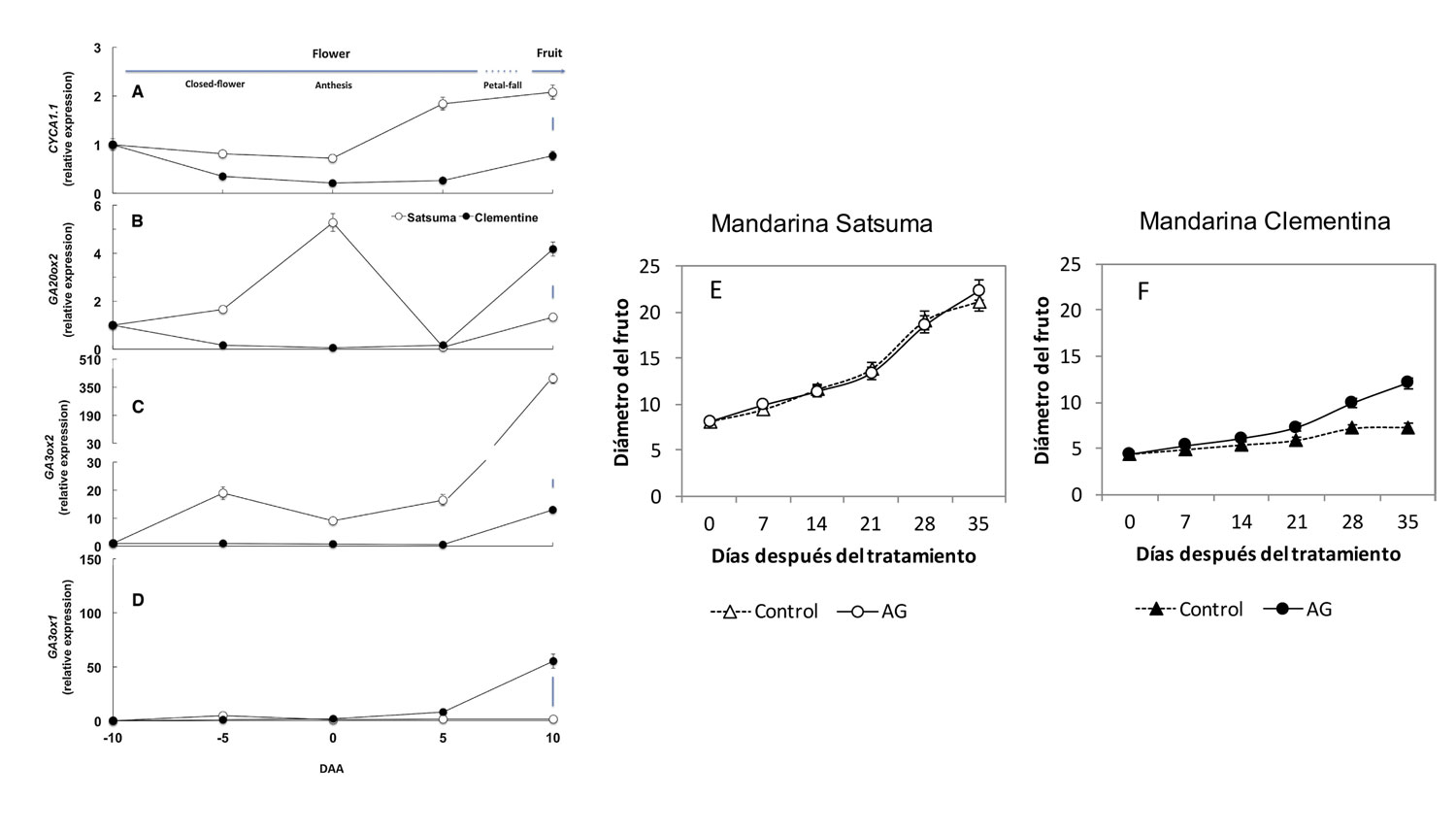
Las auxinas están relacionadas con el proceso de elongación celular durante el crecimiento del fruto y, por tanto, con su tamaño final (El-Otmani et al., 1995; 2000). Sin embargo, tanto auxinas como citoquininas se relacionan también con un estímulo de la síntesis de GAs en los estados iniciales del cuajado (Bermejo et al., 2017).Finalmente, el ácido abscísico (ABA) actúa como un potente inhibidor del desarrollo y activador de la abscisión. En condiciones normales, tanto durante la caída de pétalos como en la transición de la fase de división celular a la de elongación celular, la concentración de ABA aumenta en aquéllos ovarios con reducida tasa de crecimiento, cuya abscisión se ve significativamente incrementada (Zacarías et al., 1995).
Referencias bibliográficas
- Agustí., M. Citricultura. Ed. Mundi-Prensa, Madrid.
- Agustí, M., García-Marí, F., & Guardiola, J. L. (1982). The influence of flowering intensity on the shedding of reproductive structures in sweet orange. Scientia Horticulturae, 17(4), 343-352
- Bermejo, A., Martínez-Alcántara, B., Martínez-Cuenca, M. R., Yuste, R., Mesejo, C., Reig, C., Agustí M., Primo-Millo E., & Iglesias, D. J. (2016). Biosynthesis and Contents of Gibberellins in Seeded and Seedless Sweet Orange (Citrus sinensis L. Osbeck) Cultivars. Journal of plant growth regulation, 35(4), 1036-1048.
- Bermejo, A., Granero, B., Mesejo, C., Reig, C., Tejedo, V., Agustí, M., Primo-Millo E., & Iglesias, D. J. (2018). Auxin and Gibberellin Interact in Citrus Fruit Set. Journal of Plant Growth Regulation, in press on-line first.
- El- Otmani, M., Lovatt, C. L., Coggins, C. W. Jr., y Agustí, M. 1995. Plant Growth Regulators in Citriculture: Factors Regulating Endogenous Levels in Citrus Tissues. Critical Reviews in Plant Sciences, 15(5): 367-412.
- El- Otmani, M., Coggins, C. W. Jr., Agustí, M. and Lovatt, C. L. 2000. Plant Growth Regulators in Citriculture: World Current Uses. Critical Reviews in Plant Sciences, 19(5): 395-447.
- Gómez-Cadenas, A., Mehouachi, J., Tadeo, F. R., Primo-Millo, E., & Talon, M. (2000). Hormonal regulation of fruitlet abscission induced by carbohydrate shortage in citrus. Planta, 210(4), 636-643.
- Martínez-Alcántara, B., Iglesias, D. J., Reig, C., Mesejo, C., Agustí, M., & Primo-Millo, E. (2015). Carbon utilization by fruit limits shoot growth in alternate-bearing citrus trees. Journal of plant physiology, 176, 108-117.
- Mehouachi, J., Serna, D., Zaragoza, S., Agusti, M., Talon, M., & Primo-Millo, E. (1995). Defoliation increases fruit abscission and reduces carbohydrate levels in developing fruits and woody tissues of Citrus unshiu. Plant Science, 107(2), 189-197.
- Mesejo, C., Yuste, R., Martínez-Fuentes, A., Reig, C., Iglesias, D. J., Primo-Millo, E., & Agustí, M. (2013). Self-pollination and parthenocarpic ability in developing ovaries of self-incompatible Clementine mandarins (Citrus clementina). Physiologia plantarum, 148(1), 87-96.
- Mesejo, C., Yuste, R., Reig, C., Martínez-Fuentes, A., Iglesias, D. J., Muñoz-Fambuena, N., Bermejo, A., Germanà, MA., Primo-Millo, E. & Agustí, M. (2016). Gibberellin reactivates and maintains ovary-wall cell division causing fruit set in parthenocarpic Citrus species. Plant Science, 247, 13-24.
- Rivas, F., Gravina, A., & Agustí, M. (2007). Girdling effects on fruit set and quantum yield efficiency of PSII in two Citrus cultivars. Tree physiology, 27(4), 527-535.
- Talon, M., Zacarias, L., & Primo-Millo, E. (1992). Gibberellins and parthenocarpic ability in developing ovaries of seedless mandarins. Plant physiology, 99(4), 1575-1581.
- Werner, T., Holst, K., Pörs, Y., Guivarc'h, A., Mustroph, A., Chriqui, D., Grimm, B. y Schmülling, T. (2008). Cytokinin deficiency causes distinct changes of sink and source parameters in tobacco shoots and roots. J. Exp. Bot. 59, 2659-2672. ?
- Zacarias, L., Talon, M., Ben-Cheikh, W., Lafuente, M. T., & Primo-Millo, E. (1995). Abscisic acid increases in non-growing and paclobutrazol-treated fruits of seedless mandarins. Physiologia Plantarum, 95(4), 613-619.















