El Departamento de Protección de Cultivos del IAS-CSIC ha orientado parte de sus recursos al desarrollo de métodos de control de jopo en zanahoria desde comienzos de 2025
La infección de jopo en cultivos de zanahoria: una amenaza fitosanitaria creciente pero ignorada en España
Mónica Fernández-Aparicio1, Clive Evans2, Luis Marín3, Francisca López-Granados1, Antonio Cala Peralta4, Jesús G. Zorrilla4 y Blanca B. Landa1
1Departamento de Protección de Cultivos. Instituto de Agricultura Sostenible (IAS-CSIC), Avenida Menéndez Pidal s/n. 14004 Córdoba
2Frontera Marketing, Jerez de la Frontera, 11405 Cádiz
3Asociafruit, Av. Málaga 16, 41004 Sevilla
4Grupo de Alelopatía, Departamento de Química Orgánica, Instituto de Biomoléculas (INBIO), Facultad de Ciencias, Universidad de Cádiz, C/ República Saharaui, 7, 11510 Puerto Real (Cádiz).
26/06/2025En los últimos años se han dedicado importantes esfuerzos tanto a nivel nacional como internacional dirigidos al control del jopo en cultivos como las leguminosas, el girasol, la colza, el cáñamo y el tabaco. A pesar de que el jopo amenaza de manera creciente la sostenibilidad del cultivo de zanahoria en España, su impacto ha sido hasta ahora ignorado o considerado secundario.
Según el Anuario de Estadística Agraria (1), en España se cultivaron un total de 6.982 hectáreas de zanahoria en 2022, situándose como el cuarto país europeo con mayor superficie dedicada a este tipo de cultivo. De esta superficie, un 42% se concentra en Andalucía, especialmente en las provincias de Cádiz y Sevilla, que representan el 29% y el 13% de la superficie nacional, respectivamente. La productividad registrada en estas provincias fue de 110.015 toneladas en Cádiz y 45.320 toneladas en Sevilla, lo que pone de manifiesto la importancia estratégica de esta región para el abastecimiento nacional y la exportación de zanahoria.

Con el objetivo de desarrollar nuevas variedades de zanahoria con mecanismos alternativos de resistencia a la infección de jopo, el IAS-CSIC está llevando a cabo un ambicioso programa de identificación y caracterización de germoplasma resistente.
La Red de Alerta e Información Fitosanitaria de Andalucía (2) destaca como principales plagas y enfermedades que afectan al cultivo de zanahoria las de gusanos grises y de alambre, los nematodos, la alternaria, el oídio, la roya, y otras enfermedades fúngicas causadas por Alternaria, Sclerotinia y Rhizoctonia; sin embargo, no se incluye al jopo como un problema.
El jopo es una planta parásita conocida por infectar las raíces de cultivos como las leguminosas, el girasol, la colza, el cáñamo y el tabaco causando graves pérdidas de rendimiento (3,4). En consecuencia, se han dedicado importantes esfuerzos tanto a nivel nacional como internacional dirigidos al control del jopo en cultivos como los anteriormente citados. A pesar de que el jopo amenaza de manera creciente la sostenibilidad del cultivo de zanahoria en España, su impacto ha sido hasta ahora, ignorado o considerado secundario (2).
El Instituto de Agricultura Sostenible (IAS-CSIC), con sede en Córdoba, se ha consolidado como un referente internacional en la investigación sobre malas hierbas parásitas de cultivos de leguminosas y girasol, fundamentalmente por las investigaciones que viene realizando en jopo desde hace varias décadas. Estas investigaciones han abordado el estudio del proceso de infección para el desarrollo de diferentes estrategias de control.
Éstas incluyen el uso de resistencia genética, la optimización del uso de herbicidas comerciales y el empleo de moléculas naturales con acción alelopática (4,5). Dentro del IAS-CSIC, el Departamento de Protección de Cultivos ha orientado parte de sus recursos al desarrollo de métodos de control de jopo en zanahoria desde comienzos del año en curso.
¿Qué es el jopo?
Los jopos son plantas parásitas pertenecientes a la familia Orobanchaceae. Existen más de 100 especies de jopo, englobadas en los géneros Orobanche y Phelipanche, que parasitan las raíces de plantas huéspedes manteniendo en muchos casos una presencia equilibrada en sus hábitats naturales. Su amenaza es creciente, puesto que siete especies de jopo se han especializado como malas hierbas, parasitando cultivos de manera agresiva causando graves daños en las cosechas no solo a nivel nacional, sino de manera reconocida a nivel mundial (4).
En España, tres de estas especies, Orobanche crenata, Orobanche cumana y Phelipanche ramosa, son de especial preocupación en los cultivos de leguminosas, girasol, tomate, cáñamo, tabaco y colza. A pesar de que la infección de O. crenata en zanahoria (Figura 1A) es considerada un problema fitosanitario secundario por la administración (2), esta especie de jopo causa gravísimos daños a los cultivos de zanahoria en Andalucía (Figura 1B).
El jopo causa pérdidas cuantitativas y cualitativas en la cosecha de zanahoria al reducir la biomasa de las raíces pivotantes y su contenido de azúcar, produciendo deformaciones y lesiones en ellas. En otros países como Israel, la especie Phelipanche aegyptiaca causa graves afecciones a los cultivos de zanahoria, como así ocurre también en Francia con P. ramosa, siendo estas plagas reconocidas como problemas fitosanitarios de relevancia.

Figura 1. (A) Detalle de un jopo (Orobanche crenata) en floración infectando plantas de zanahoria. (B) Cultivo de zanahoria severamente afectado por jopo en la provincia de Cádiz.
¿Cómo es capaz una planta de jopo de parasitar a otra planta?
Los jopos son plantas holoparásitas obligadas, lo que significa que carecen de actividad fotosintética y sistema radicular. Después de la germinación, de la semilla de jopo emerge una pequeña radícula de longitud máxima 3 mm (figura 2A) cuya función es adherirse a la raíz del cultivo desarrollando un órgano invasivo denominado haustorio (Figura 2B). A través de este haustorio el jopo penetra en la raíz de la planta huésped y conecta con su sistema vascular para extraer nutrientes y agua con los que desarrollará primero un tubérculo (Figura 2C) útil para el almacenamiento de nutrientes procedentes del huésped, para, a continuación, diferenciar un tallo subterráneo que crece para emerger hacia la superficie y posteriormente florecer y producir semillas en periodos breves de tiempo (figura 2D). Estas semillas serán dispersadas, principalmente, mediante mecanismos pasivos como el viento (4). Una vez que el jopo ha emergido, el daño al cultivo se considera ya producido. Por tanto, el control efectivo de jopo debe realizarse en los estados iniciales de su ciclo de vida.

Figura 2. (A) Germinación de jopo (Orobanche crenata). (B) Radículas de jopo adheridas a la raíz de zanahoria. (C) Diferentes estados de penetración de jopo en raíces de zanahoria (*conexión vascular recién formada; ** pequeño nódulo sin raíces de anclaje; *** nódulo con raíces de anclaje recién formadas). (E) Jopos emergidos en estados fenológicos de floración y maduración de semilla.
Debido a la incapacidad del jopo para sobrevivir de manera independiente, la evolución de estas plantas ha hecho que desarrollen estrategias que aseguren la máxima probabilidad de establecer una conexión con la planta huésped. En primer lugar, cada planta de jopo produce cientos de miles de semillas, tan pequeñas y ligeras como partículas de polvo que invaden cada centímetro del perfil cultivable de los campos de cultivo infestados.
En segundo lugar, estas semillas mantienen su germinación inhibida hasta que detectan la presencia del cultivo huésped al reconocer moléculas específicas exudadas por las raíces de los cultivos (4). Debido a estas estrategias de reproducción y germinación, junto con la íntima conexión física y metabólica que el jopo establece de manera subterránea con el cultivo, el control de jopo es extremadamente difícil, siendo ineficaces la mayoría de las estrategias basadas en el empleo de herbicidas comúnmente utilizadas para el control de otros tipos de malas hierbas.
¿Qué estrategias son eficaces para el control de jopo?
El control eficaz de la infección de jopo en cultivos se realiza principalmente a través de la aplicación de herbicidas sistémicos sobre el sistema foliar del cultivo, (4,5) incluyendo el empleo de glifosato, imidazolinonas o sulfonilureas, que se traslocan al jopo subterráneo a través del haustorio. Otras alternativas de control incluyen el cultivo de variedades resistentes a la infección, la utilización de plantas alelopáticas y moléculas naturales con acción herbicida sobre la semilla de jopo.
En zonas con climatologías favorables, se pueden llevar a cabo modificaciones culturales que se basan fundamentalmente en ajustar la fecha de siembra a fechas en las que las condiciones ambientales desfavorecen la germinación de jopo, o en las que se desfavorece la fuerza del sumidero parásito equilibrando las relaciones tróficas que se establecen entre el parásito y el cultivo a favor del cultivo. Estas estrategias deben ser adaptadas específicamente para cada especie de cultivo infectado y para cada especie de jopo.
Para el caso de zanahoria, investigadores israelíes (6,7) seleccionaron herbicidas sistémicos que, aplicados a bajas dosis, permitían controlar el jopo sin producir efectos nocivos en la zanahoria. Tales experimentos demostraron que herbicidas como imazapic o imazamox, altamente eficaces en otros cultivos para el control de jopo (4,5), causan graves daños en la raíz de zanahoria incluso cuando son aplicados a bajas dosis (6,7). Por el contrario, demostraron que tres aplicaciones secuenciales (6, 9 y 12 semanas después de la siembra) de bajas dosis de glifosato (108 g de materia activa/ha; o en su formato comercial ‘Roundup’ de 0,3 L/ha) en el sistema foliar de zanahoria, permite controlar completamente el jopo (P. aegyptiaca) en estado subterráneo, antes de causar sus efectos nocivos sobre la zanahoria, y sin observarse efectos fitotóxicos causados por el herbicida.
Cuando el glifosato es aplicado sobre el sistema foliar del cultivo, rápidamente se trasloca a través del floema a los sumideros más activos de la planta. El jopo, conectado mediante su haustorio al sistema vascular del cultivo, constituye el sumidero hacia el que el glifosato se traslada principalmente. Para utilizar esta estrategia herbicida de manera correcta y eficaz, es necesario tener en cuenta el estado fenológico del jopo, ya que el éxito de esta estrategia depende de que el jopo se encuentre en el estado de pequeños tubérculos con o sin raíces de anclaje sin yema floral diferenciada (Figura 2C y figura 3B).
Si el glifosato se aplica de manera prematura, las conexiones vasculares de los jopos cercanos al sistema radicular del cultivo todavía no se han establecido completamente, por lo que el parásito no se ve afectado y permitiendo que establezca la conexión con el huésped posteriormente, una vez que el rápido efecto del herbicida ha sido ya producido. Si el glifosato se aplica demasiado tarde, los jopos más maduros muestran ser insensibles a las bajas dosis utilizadas.
Es importante tener en cuenta que dichas investigaciones emplearon la especie de jopo P. aegyptiaca que infecta los cultivos de zanahoria en Israel tanto en invierno como en verano. Sin embargo, en las condiciones propias de la región andaluza, la especie de jopo O. crenata sólo infecta zanahorias cultivadas en invierno. La eficacia del glifosato en jopo y su toxicidad en zanahoria se ve influenciada por la temperatura, por tanto, en la región andaluza deben ajustarse las condiciones de aplicación de este herbicida para definir la mínima dosis que garantice la máxima eficacia en O. crenata.
En Francia, la Agencia Nacional de Seguridad Sanitaria de la Alimentación, el Medioambiente y el Trabajo (ANSES), recomienda una dosis de 121,5 g de glifosato por ha (0,27 L de GIBSON/ha) al final del invierno para controlar el jopo en cultivos de zanahoria dedicados a la producción de semilla (8). En España, los tratamientos de glifosato a bajas dosis en estados tempranos del cultivo de zanahoria no están autorizados, lo que priva a los agricultores de una solución eficaz y económica con bajos niveles de riesgo medioambiental y sanitario cuando las dosis y condiciones de seguridad en la aplicación del herbicida son respetadas.
El cultivo de variedades resistentes a la infección de jopo es una alternativa de control eficaz y ecológica. Sin embargo, no existen variedades resistentes comercializadas para muchas de las especies de cultivos afectadas por el problema de jopo. Para el caso de zanahoria, empresas de semillas como Bejo Zaden, De Clause, y Syngenta tienen en su catálogo variedades en las que se ha observado cierto grado de resistencia o tolerancia a jopo en campo (9, 10, 11).
Utilizando experimentos in vitro, nuestro grupo ha caracterizado en una de esas variedades comerciales (variedad Nagoya, Bejo Zaden (9)), los mecanismos responsables de la respuesta de las raíces de la infección de O. crenata (Figura 3A), y a poblaciones francesas de otras dos especies de jopo (P. ramosa y Orobanche minor), confirmando para todas ellas la respuesta resistente que los técnicos de Bejo han observado en campos infestados por O. crenata (9).
Nuestro grupo ha manifestado su interés en estudiar también variedades de Syngenta y De Clause, con quienes se ha intentado establecer contacto. Hasta la fecha, no se ha concretado una colaboración, aunque se mantiene la disposición a futuras interacciones con estas u otras empresas del sector.
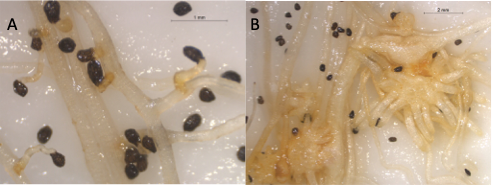
Figura 3. (A) Respuesta resistente a la infección de Orobanche crenata observada en raíces de variedad Nagoya. (B) Respuesta susceptible a O. crenata en raíces de variedad de zanahoria control.
A la vez, con el objetivo de desarrollar nuevas variedades de zanahoria con mecanismos alternativos de resistencia a la infección de jopo, el IAS-CSIC está llevando a cabo un ambicioso programa de identificación y caracterización de germoplasma resistente, mediante el estudio de cientos de variedades tradicionales y modernas y genotipos de especies de zanahoria silvestres que han sido obtenidas por el IAS-CSIC a través de colaboraciones con diversos bancos de germoplasma y centros de investigación de prestigio internacional, tales como IPK (Alemania), NordGen (Suecia), Czech Agrifood Research Center (República Checa), USDA (Estados Unidos) y Julius Kühn-Institut (Alemania).
En paralelo, y con el fin de desarrollar herbicidas naturales que puedan ser utilizados como alternativas a sistemas de control tradicional, el IAS-CSIC junto con la Universidad de Cádiz está llevando a cabo un programa de purificación y caracterización de librerías de moléculas y aceites esenciales procedentes de plantas, microorganismos, y residuos de la industria olivarera con el objetivo de identificar moléculas con capacidad de inhibir el desarrollo de la infección de O. crenata y otras especies de jopo.
De esta manera, se ha concluido que lactonas sesquiterpénicas como la anhidrojudaicina, la cnicina, la isocnicina y el salonitenolido, o metabolitos estructuralmente más sencillos como la (4Z)-lactona de lachnophyllum o el 4-hidroxibenzoato de metilo, todos éstos de origen vegetal producidos por Artemisia canariensis, Centaurea cineraria y Conyza bonariensis, presentan actividad interfiriendo en fases tempranas del proceso de infección de jopo (12-14).
Los resultados de bioactividad que hemos obtenido son prometedores, pero son necesarias investigaciones multidisciplinares posteriores, incluyendo estudios de ecotoxicidad (15), que determinen la verdadera aplicabilidad de metabolitos como los anteriormente citados para el desarrollo de bioherbicidas.
La eficacia del glifosato en jopo y su toxicidad en zanahoria se ve influenciada por la temperatura, por tanto, en la región andaluza deben ajustarse las condiciones de aplicación de este herbicida
Referencias
1. https://www.mapa.gob.es/es/estadistica/temas/publicaciones/anuario-de-estadistica/2023/
3. https://doi.org/10.3389/fpls.2016.01409
4. https://doi.org/10.3389/fpls.2016.00135
5. https://doi.org/10.1111/j.1365-3180.1991.tb01762.x
6. https://doi.org/10.1614/WS-D-15-00123.1
7. https://doi.org/10.1614/WT-D-14-00140.1
8. https://www.anses.fr/en/system/files/phyto/evaluations/DPR2012ha0673.pdf
9. https://revistamercados.com/nagoya-la-nueva-variedad-de-zanahoria-tolerante-a-jopo/
10. https://revistamercados.com/articulos/zanahorias-de-clause-la-innovacion-constante/
12. https://doi.org/10.1016/j.phytol.2019.04.014
13. https://doi.org/10.3390/molecules27217421

























