Uno de cada seis ensayos clínicos que se realiza en España ya es para investigar medicamentos huérfanos
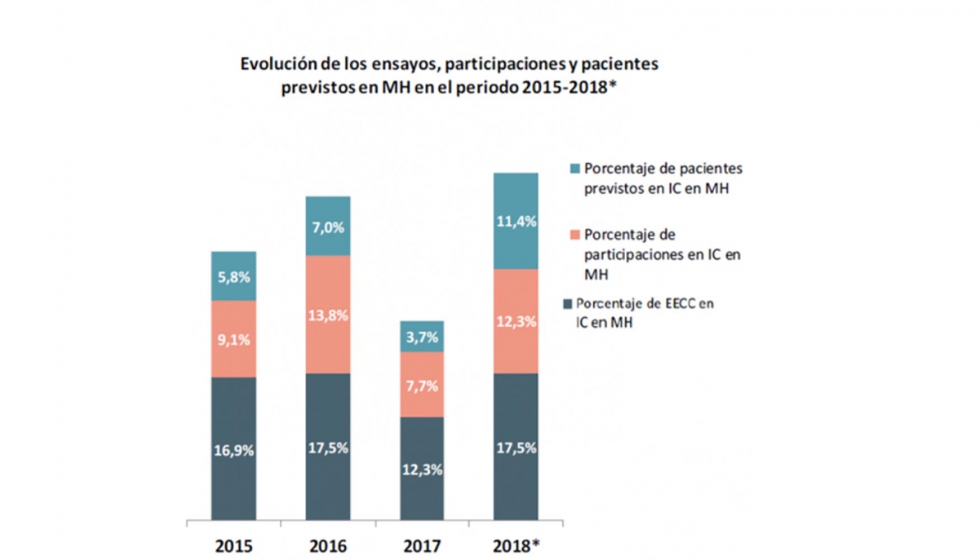
Cerca del 16% de los ensayos clínicos (15,8%) que promovieron en España las compañías farmacéuticas entre 2015 y el primer semestre de 2018 (uno de cada seis) corresponden ya a medicamentos designados como huérfanos y, por tanto, dirigidos a tratar alguna patología poco prevalente. Con mayor concreción, de los 761 estudios que contiene la muestra, 121 corresponden a este tipo de fármacos, y en ellos está prevista la participación de 2.356 pacientes. Son cifras obtenidas de la base de datos del Proyecto BEST de fomento de la I+D biomédica impulsado por Farmaindustria, que monitoriza la actividad investigadora de 50 compañías farmacéuticas, cuatro grupos de investigación cooperativa y 54 centros hospitalarios del país.
Esta información ha sido actualizada recientemente con un enfoque retrospectivo y cotejada con el Registro Español de Estudios Clínicos (REEC) de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), tal y como ha expuesto este miércoles Amelia Martín Uranga, responsable de la Plataforma de Medicamentos Innovadores de Farmaindustria, en la mesa redonda Industria e investigación en enfermedades raras dentro del IX Congreso Internacional de Medicamentos Huérfanos y Enfermedades Raras, que se ha celebrado del 13 al 15 de febrero en Sevilla.
Mejora notable
Las cifras del Proyecto BEST expuestas en Sevilla reflejan una actividad creciente de la industria farmacéutica innovadora en el ámbito de la I+D en enfermedades raras. De hecho, y tras la revisión realizada, mejoran notablemente las anteriores, publicadas el año pasado y que hablaban de un 10,8% de ensayos en fármacos huérfanos en el periodo 2015-2017.
Territorialmente, este esfuerzo investigador se concentra especialmente en Cataluña y Madrid, a las que siguen Andalucía y Valencia. Por áreas de patología, se registra mayor porcentaje de ensayos clínicos en tumores poco frecuentes (42,1%) y hematología (36,4%), seguidos por aparato respiratorio (4,9%) y cardiovascular (4,1%).
La muestra analizada refleja que los indicadores de gestión de los ensayos clínicos en medicamentos huérfanos (plazos de tramitación y puesta en marcha o datos de reclutamiento) son similares a los del resto de estudios, aunque con un par de matices. Tanto el tiempo necesario para reclutar al primer paciente como el porcentaje de centros que no reclutan son mejorables, si bien cuentan con el obstáculo que supone encontrar pacientes adecuados para un ensayo clínico en estas patologías.
Fuerte apuesta de las compañías farmacéuticas
Martín Uranga explicó que Farmaindustria refleja de forma fiel el creciente compromiso de las compañías asociadas con la investigación en este ámbito y expuso la potencial utilidad para los promotores de ensayos clínicos en este ámbito de dos proyectos desarrollados por la Asociación en los últimos años: la Guía de Unidades de Investigación Clínica en Fases Tempranas, cuya tercera edición estará disponible en los próximos meses y que reúne ya información de 37 centros, y la Guía de Investigación Clínica en Pediatría, editada en septiembre de 2017 y con información sobre 30 unidades.
También destacó la importancia de la colaboración público-privada en este terreno y señaló dos proyectos IMI de cooperación entre la Comisión Europea y la industria farmacéutica como ejemplos adecuados de este modelo de investigación cooperativa que es ya una realidad. Por una parte, la iniciativa Connect 4 Children (C4C), en la que trabajan 33 socios académicos y 10 compañías farmacéuticas y uno de cuyos objetivos es promover nuevos diseños para ensayos clínicos que faciliten el desarrollo de tratamientos contra enfermedades raras pediátricas. La otra propuesta es Paradigm, que pretende articular mejor la participación significativa de los pacientes en el desarrollo de nuevos fármacos, un campo en el que los colectivos de pacientes y familiares de enfermedades raras ofrecen una amplia experiencia.
El fruto de este esfuerzo investigador en aumento ya es una realidad en los datos de aprobación de nuevos tratamientos por parte de las agencias reguladoras. De esta manera, de las 42 nuevas moléculas aprobadas en 2018 por la Agencia Europea del Medicamento (EMA en sus siglas en inglés), la mitad de ellas (21) eran medicamentos huérfanos. Igualmente, 34 de los 59 tratamientos aprobados (el 58%) por la FDA, la agencia estadounidense, eran diseñados para el abordaje de alguna patología poco frecuente.
La representante de Farmaindustria señaló, de cara al futuro, la importancia de los avances alcanzados en el campo de la genómica tanto para el mejor diagnóstico de las enfermedades poco prevalentes (un 80% son de origen genético) como para el desarrollo de nuevos tratamientos. Por ello, hizo hincapié en la necesidad de desarrollar un Plan Nacional de Medicina de Precisión que incluya el campo de la genómica como pilar principal, tal y como ya ha recomendado la Ponencia de Estudio sobre Genómica del Senado.
El esfuerzo de las compañías farmacéuticas ha sido reconocido también por los organizadores del encuentro de Sevilla. Así, entre las conclusiones del Congreso destaca el mensaje de que “la industria farmacéutica es ahora consciente de la importancia del desarrollo de nuevos productos para el diagnóstico, prevención y tratamiento de las enfermedades raras”.