Entrevista a Antonio Gutiérrez, director general de Domino España

La FMD (2011/62/UE) es una directiva de obligado cumplimiento. Se aprobó en 2011, y el pasado 2 de enero se inició el plazo para que cada uno de los países de la Unión Europea la adapte a sus características locales como país. Para ello tienen 18 meses.
Es decir, ¿no entrará en vigor hasta mediados de 2014?
Ya están marcadas las líneas y las tendencias que habrá que implantar, y ahora mismo estamos a la espera de que se publique el Delegated Act, que reunirá elementos específicos y concretos. Una vez se haya publicado, los fabricantes tendrán 3 años más para adaptarse a ella, antes de que pase a ser de obligado cumplimiento, es decir, a principios de 2017.
¿Y no es un poco precipitado iniciar ahora la adaptación sin saber cómo será definitivamente?
Bueno, hay una serie de interrogantes que dependen de ese Delegated Act que comento. Quedan pendientes cuestiones como cuántos dígitos tendrá el código o si será en formato Data Matrix, en 2D, u otro tipo de código. No se le puede plantear a una farmacéutica que realice en este momento una inversión en sus fábricas para adaptarse a una directiva que todavía no conocemos en su totalidad. Lo que sí recomiendo es que empiecen ya a hacer pruebas piloto. Sí se sabe que habrá que serializar todo fármaco con un código único que luego que se verificará.
¿Dónde se verificará?
No se trata de un proyecto de track and trace sino de prevención de falsificación, por lo tanto se verificará de forma obligatoria en el lugar donde se entregue el artículo al cliente final, es decir, en las farmacias, para comprobar que ese producto es original. Además, de forma voluntaria, se pueden establecer controles de verificación en los empaquetadores.
¿En los empaquetadores?
Sí, en muchos casos el fabricante desarrolla el producto y se lo entrega a un envasador para que lo empaquete. Como hay una rotura en la línea, es conveniente que se vuelva a verificar la autenticidad del producto.

Pero un producto se presenta dentro de un envase, que a su vez se distribuye en una caja con más envases de más productos, que a su vez forma parte de un palé. Este hecho puede plantear problemas, ¿no?
Efectivamente. Por ello, el código de la caja y del palé debe dar información de qué productos contiene y de dónde provienen cada uno de ellos, de qué línea y de qué fábrica. En la actualidad, cada uno de los fabricantes tiene su propio registro, especialmente en la industria alimentaria, ya que en situación de crisis tienen 24 horas para identificar de dónde han salido los productos y dónde se encuentran en cada momento para que, si así se estima, proceder a su retirada. En el caso de la industria farmacéutica se trata de una medida preventiva para que el producto vaya bien identificado, la premisa básica.
¿Y una vez identificado?
Ese código se tiene que leer, verificar, almacenar y buscar un sistema de recuperación para ir hacia atrás, para llegar hasta donde se produjo.
La implantación de todas estas medidas traerá consigo un coste que repercutirá en el fabricante…
Pues sí. Obligatoriamente necesitará un equipo nuevo y —algunos fabricantes de forma voluntaria ya lo tienen— necesitarán nuevos sistemas informáticos. Aunque existe en algunos casos, se deberá crear una, por así decirlo, nube donde se va almacenar, manejar y gestionar la información. Todo ello inevitablemente requerirá una inversión importante.
¿Y podrán nuestras empresas del sector asumir esa inversión?
Personalmente creo que la industria farmacéutica está preparada para afrontar el proceso. La protección de la cadena de valor del negocio farmacéutico es muy importante porque si no se toman estas medidas se deteriorará y se romperá la estructura del sector.
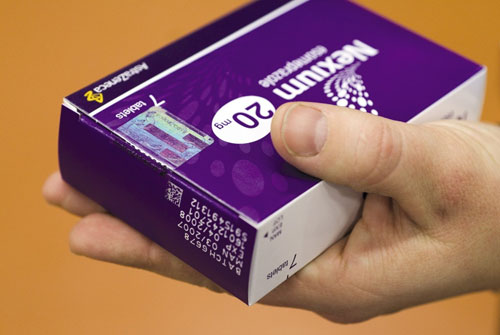
¿Qué elementos incorporará el envase a partir de ahora para evitar su falsificación?
Cada fabricante busca su manera para que no se puedan manipular sus envases para introducir un producto que no coincida con lo que dice la etiqueta. En todo caso, en cuanto a los requerimientos de la directiva, deberá llevar un código y un envase precintado que no se pueda alterar.
¿Y qué equipos y sistemas necesitará el fabricante para cumplir con la directiva?
Esto tendrá también un coste para las farmacias…
Todas tienen sistemas de ese tipo, pero para otros propósitos. Ahora, además, tendrán que verificar el producto. No será sólo un coste más, también hay un conjunto de oportunidades asociadas para ganar eficacia, para hacer las cosas de una forma simple y conocida por todos. La farmacia es el punto clave, y además obligatorio, para verificar que el producto está validado por el fabricante.

¿Qué puede aportar Domino a este nuevo orden de cosas?
Tenemos nuestros propios productos de propósito genérico y estamos al corriente de cuáles son las tendencias de la ley. Nuestra pretensión es suministrar el producto, la visión, el sistema informático, el software… hasta donde podamos llegar. En estos momentos no hay nadie capaz de ofrecer todo lo necesario para el cumplimiento de la directiva. No pretendemos vender sólo un equipo de codificación de tecnología láser o inkjet, sino suministrar una solución completa, para que el cliente no tenga que contactar con cuatro especialistas diferentes.

















