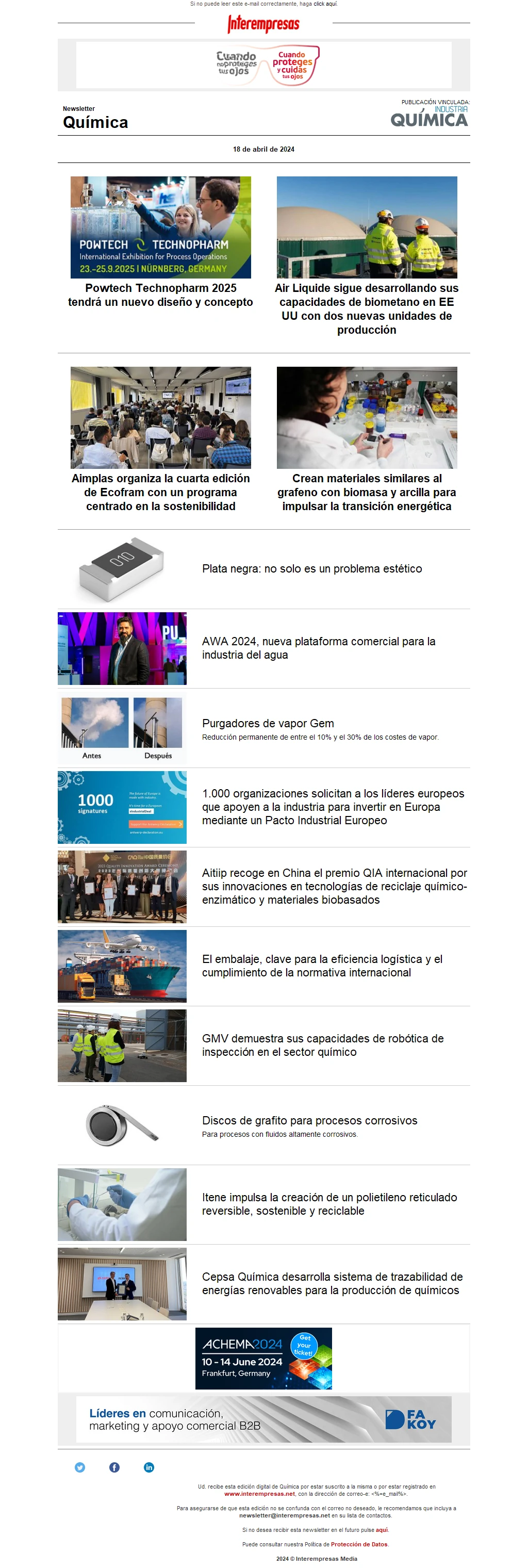
Nueva batería de litio con nanocarbono y silicio
El nuevo ánodo ha sido desarrollado por Argonne National Laboratory, con una densidad energética de 525 Wh/kg, y con una capacidad de corriente del ánodo de 1.250 mA/g. La densidad energética de una batería de litio convencional es de 140-160 Wh/kg. Eso supone multiplicar por 3,28 la densidad energética de la batería convencional de ión-litio, y por 4 la capacidad del ánodo. La vida de la batería alcanza los 5.000 ciclos de descarga. Durante la descarga el ánodo libera iones positivos de litio, que migran por el electrolito hacia el cátodo, y se insertan en él. Por cada ión liberado por el ánodo surge un electrón hacia el circuito exterior.
Para cargar la batería hay que invertir el sentido de la corriente. La cantidad de energía almacenada en la batería es proporcional a la diferencia de potencial entre los electrodos, 3,6 V. Recordemos que el nanosilicio tiene una capacidad de absorción de átomos de litio que supera en diez veces al ánodo convencional. El último desarrollo ha ocurrido en 2014: el pasado 8 de junio, la Universidad de California, en Riverside, publicó la investigación de Zachary Favors sobre el silicio que llaman 3D, tridimensional. En Cedar Creek, Texas, abunda la arena de cuarzo, SiO2. La arena ha sido molida por Z. Favors hasta escala nanométrica como paso previo para lograr silicio puro. La arena se mezcla con magnesio, se calienta a alta temperatura, el magnesio capta el oxígeno del SiO2, y logramos nanosilicio puro, pero además poroso, una esponja de Si.
El silicio en el ánodo de la batería ofrece una gran superficie, que permite a los iones de litio aumentar su velocidad de desplazamiento. Para aumentar la eficiencia el silicio, éste está impregnado de nanocarbono. Favors ha logrado con ese silicio fabricar una pila del tamaño de una moneda, y ha comprobado que el ánodo de nanosilicio triplica la eficiencia y vida útil de la bateria ión litio. Ahora Calbattery, en unión con Caleb, fabrican esa pila para teléfonos móviles. Ese mismo ánodo será empleado para la batería LinPoly, de Caleb Technologies, que contiene polímero en el electrolito de ión litio.
El nuevo ánodo ha sido desarrollado por Argonne National Laboratory.
Los electrodos nanoestructurados no se los imaginaba Alessandro Volta, cuando en 1800 inventó la batería eléctrica. Tampoco se imaginaba Volta que la batería serviría para algo, al comunicar el 20 de marzo de 1800 su descubrimiento a la Royal London Society. El desarrollo de los electrodos nanoestructurados tenía que ocurrir algún día, porque la capacidad energética en Amp/h de la pila depende de la superficie de los electrodos y del electrolito. Cuanto mayor sea el electrodo mayor será la vida útil.
Pero la capacidad disminuye con una descarga rápida: la capacidad será menor de la esperada. Por tanto, una batería de 100 Ah dará 5 A durante 20 horas. Pero si la descargamos a 50 A se agotará antes de cumplir las dos horas esperadas. La ley de Peukert relaciona la eficiencia de la batería en función de la descarga y de la temperatura. Una batería de litio-ión de 200 A/h entregará menos energía que la que recibió en la carga, entre otras razones, porque el voltaje durante la carga es más elevado que durante la descarga, pero con litio-ión la diferencia es muy pequeña (99% de rendimiento). En la batería de níquel-cadmio el rendimiento es de sólo el 66%. El voltaje del litio-ión depende sólo de la química, y no de si está cargada o vacía. No obstante, su resistencia interna aumenta a medida que la batería se agota: disminuye su voltaje y sus posibilidades de entregar amperios.
El potencial electroquímico del litio
En la tabla de los elementos de Mendeleiev no encontramos nada mejor para la batería que el litio. Tiene muchos méritos, pero el mejor es su potencial electroquímico: -3.05, el más negativo de todos los elementos. Tiene solo un electrón de valencia, que lo cede con facilidad para formar un catión. Hay dos isótopos, de peso 6 y 7. Con una densidad de 0,534 g/cm3 es el más ligero de los elementos sólidos. Flota en los hidrocarburos. Expuesto al agua y al aire se enciende y quema, muy reactivo, incluso con el gas nitrógeno a temperatura ordinaria. Es blando y se puede cortar con un cuchillo. Permite lograr baterías con alta densidad energética. En nuestro planeta es relativamente abundante en forma de compuestos. En la industria se logra por electrólisis de una mezcla de cloruro de litio y cloruro potásico. El país más productor de litio es Chile. Además, recordemos el salar de Uyuni, una enorme costra de sal en los Andes.
Durante la descarga los electrones del ánodo circulan por el circuito exterior. En el ánodo se produce oxidación, y en el cátodo reducción. La oxidación – reducción se produce simultáneamente. La primera bateria fue presentada por Sony en 1991, con óxido de cobalto y litio. En 1996 Padhi usó el fosfato de LiFe como cátodo, y evitó el cobalto. En 2004 aparece el nanofosfato, de un tamaño inferior a 100 nm, con lo que logró aumentar por 100 la superficie del electrodo. Al aumentar esta superficie disminuyó la resistencia interna y aumentó la potencia disponible. Ahora con la espuma de grafito hemos logrado multiplicar por 5 la potencia, debido al aumento de la superficie del electrodo. El litio se mueve entre el ánodo y el cátodo con un proceso reversible: cuando se descarga la bateria el Li se extrae del ánodo, y se inserta en el cátodo. Al cargar la batería, el contrario, el Li se extrae del cátodo y se inserta en el ánodo.

Triplica la autonomía del coche eléctrico.
Litio-ión con cobalto
Para el material activo del cátodo resulta muy atractivo en California el cobalto, metal muy tóxico, apto para aumentar la densidad energética de la pila de ión litio. Ese atractivo resulta extraño por los riesgos del cobalto. Recordemos aquí la electroquímica de esa pila:
El cátodo, electrodo positivo, es un óxido de un metal de transición, cobalto, manganeso y hierro. El ánodo es nanocarbono. En ambos electrodos hay polvo de litio. Durante la carga el cobalto es oxidado de Co3+ a Co4+. Y en la descarga es reducido de Co4+ a Co 3+. El voltaje en circuito abierto es de 3.6V, y el voltaje de carga es 4.2V. Su capacidad eléctrica es de 140mAh/g. La densidad energética es de 150-170 Wh/kg. El cobalto procede en gran parte de la República Democrática del Congo, es de alto precio, sobre todo para las baterías usadas en el transporte. Se suele reemplazar por manganeso, hierro y aun níquel.
La documentación nos dice que la densidad energética promedio de la pila recargable ión litio, con cátodo de cobalto es de 158 Wh/kg, ciertamente muy elevada, mientras que la densidad de la pila níquel – cadmio es de solo 62 Wh/kg. Eso es verdad, pero el cobalto tiene la pega de su falta de estabilidad térmica, y no es compatible con corrientes intensas.
El ánodo es de espuma de grafito, que aumenta mucho la superficie del electrodo, y el cátodo era un compuesto de óxido de cobalto, manganeso o hierro. Pero debido a los problemas de incendio del cobalto, ahora preferimos el cátodo de Litio, hierro y fosfato (LiFePO4), nanoestructurado, mucho menos sensible a la temperatura, con menor riesgo de incendio, pero con 25% de pérdida de capacidad. Con potencial de 4.2-4.3V. La autodescarga es de 5% por mes, algo tolerable. Al envejecer la batería aumenta la resistencia interna, disminuye le voltaje y la corriente máxima que puede suministrar. La densidad energética del coche con batería es de solo 0.5MJ/kg, mientras que el coche con gasolina alcanza 46MJ/kg. El electrolito puede ser líquido, o sólido, una sal metálica o un disolvente orgánico. Es buen conductor de iones, y aislante para los electrones. La interfaz del electrolito es básica.
Mejoras del ánodo - cátodo
Calbattery ha mejorado el ánodo mucho con el nanocarbono y el nanosilicio, un mérito que hay que reconocer. La investigación de mejoras del ánodo avanzaba despacio, excepto en Calbattery, en cambio la investigación de materiales activos de cátodo ha sido y es muy intensa a nivel mundial. No podemos aquí explicar al lector la alta complejidad del cátodo de la pila de ión litio. Hay publicados más de un centenar de cátodos, que son aleaciones de metales, junto con compuestos, óxidos y sales metálicas, todos con sus pros y contras, para un cátodo eficaz. Ese esfuerzo vale la pena para diseñar pilas del tamaño de una moneda, para el teléfono portátil y el ordenador portátil.
Pila.
Las baterías ión litio convencionales
Ión litio en polímero:
El electrolito litio-sal no está contenido en un solvente orgánico, sino en un compuesto polimérico sólido, como el óxido de polietileno o poliacrilonitrito. Las ventajas del polímero son menores costes de fabricación, adaptabilidad a una amplia variedad de formas de empaquetado, confiabilidad y resistencia. Las baterías llamadas Lipo (litio en polímero) se pueden descargar totalmente en menos de 2 minutos.
La batería de automóvil con una autonomía de 100 kms no es aceptable, pero la batería de Calbattery de 300 kms cambia la situación. La batería de litio tiene una larga vida: algunos fabricantes muestran datos de más de 3.000 ciclos de carga/descarga, para una pérdida de capacidad de hasta el 20%. Facilidad para conocer la carga que almacenan: basta con medir en reposo el voltaje de la batería, la energía almacenada es una función del voltaje medido. Una tasa muy baja de autodescarga: cuando guardamos la batería, ésta se descarga progresivamente, aunque no la usemos. En el caso de las baterías de níquel-cadmio la autodescarga puede suponer hasta un 20% mensual. En el caso de Litio-ión es de menos de un 6% en el mismo periodo. Muchas de ellas tras seis meses de reposo, pueden retener hasta el 80% de su carga.
En España en 2013 se matricularon solo 811 automóviles eléctricos, y en 2014 de momento hasta octubre el aumento es de 4.95%. Preferir un coche con batería en vez del coche con motor de explosión supone un aumento de costes, y pocos lo aceptan. La caída del precio del petróleo tampoco ayuda al coche eléctrico: mientras en junio 2014 el precio del barril alcanzó 115.06 dólares a comienzos de diciembre ha llegado a costar menos de 70 dólares.
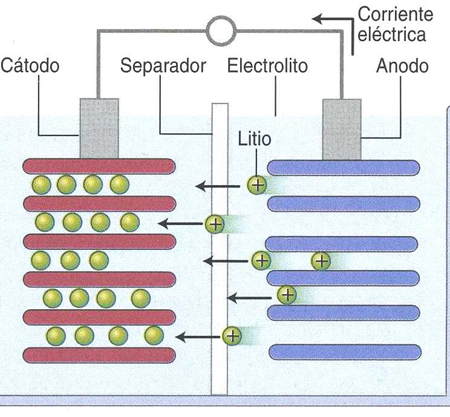
Explicación ánodo vs. cátodo.
Litio hierro fosfato:
Las de LiFePO4 son más económicas de producir, en comparación con las de cobalto (LiCoO2). Su voltaje es de 3.2 V, y un máximo de 3.65 V. Su electrodo negativo suele ser grafito. El positivo tiene ahora una superficie inmensa, sin aumento de peso ni de volumen, y con una gran capacidad eléctrica de 160mA.h/g. Lógicamente el peso/watio también ha disminuido.
Su carga es rápida. Tiene gran capacidad, apta para propulsar herramientas de potencia, sillas de ruedas, bicicletas eléctricas, automóviles y aun autobuses. La LiFePO4 tiene un carácter híbrido, con polímero en el electrolito. La batería se carga en dos fases. La segunda comienza, cuando el voltaje de la célula es de 3.65 V. La primera fase dura una hora, y la segunda, dos horas. Se puede alcanzar 4.2V con seguridad, pero es peligroso durante la carga llegar a 4.3V por descomposición del electrolito orgánico. Su densidad energética es cuatro veces la de la batería de plomo ácido, con una capacidad de 145Ah/kg.
Tipo olivino:
Además de litio también tienen hierro y fosfato, con la ventaja de que pueden duran diez años, si se cargan una vez al día. La carga es muy rápida, ya que emplean dos horas al día para el 95% de su capacidad. Sony ha divulgado esta batería de olivino. Basta recordar el proceso de sulfatación que ocurría en las baterías de zinc-carbón, cuando se almacenaban al descargarse completamente.
Bateria 500: Litio-aire
IBM en su Instituto de Almadén ha desarrollado la 500 en la que evita los pesados óxidos de metal en el cátodo; así aumenta la densidad energética, y amplia la autonomía del coche en carretera. Cuando se descarga la 500, al circular el coche, el oxígeno atmosférico reacciona con los iones de litio, y se forma peróxido de litio sobre una matriz de carbono en el ánodo. Al cargar la batería, devolvemos el oxígeno a la atmósfera, y regeneramos el metal litio en el cátodo. El electrolito es de iones de litio. No obstante el cátodo de metal litio tiene enemigos.

Cuando se descarga la 500, al circular el coche, el oxígeno atmosférico reacciona con los iones de litio, y se forma peróxido de litio sobre una matriz de carbono en el ánodo.
El nanosistema en el ión litio
Ya hemos recordado que la capacidad de la batería recargable depende de la superficie de los electrodos, una condición ya conocida hace diez años. Entonces A123 Systems recurrió a la nanotecnología para su batería de litio, con baja impedancia gracias al nanofosfato, y registró su Patente Conductive Lithium Storage Electrode. Disminuyó un poco la capacidad en Am/h, pero sin disminuir la densidad de potencia, al contrario. No hace falta decir que al aumentar la superficie de los electrodos, ha disminuido la resistencia interna de la batería. Un gran avance. Las propiedades físicas y químicas de la materia cambian a escala nanométrica, lo cual se debe a efectos cuánticos. La conductividad eléctrica, el calor, la resistencia, la elasticidad, la reactividad, entre otras propiedades, se comportan de manera diferente que en los mismos elementos a escala macro. Es una tecnología basada en la manipulación detallada de las estructuras moleculares.
La característica fundamental de la nanotecnología es el ensamblaje interdisciplinar de varios campos científicos, altamente especializados, que se apoyan en la mecánica cuántica. La química es muy importante para alcanzar la estructura nano del material deseado, operando a escala molecular. Con el nanofosfato de litio y hierro se ha conseguido un electrodo con una superficie inmensa, sin aumento de peso, y una gran capacidad de 160 mAh/g. Lógicamente el peso/watio también ha disminuido. El coste de la LiFePO4 sigue alto. El nanofosfato de Litio y hierro se usa en la batería de las herramientas de potencia sin cordón, introducida por DeWalt, Black y Decker. Hasta ahora había que adquirir para el coche una batería de más capacidad de lo necesario, en previsión de que envejecerá la batería. Con la de nanofosfato basta adquirir la capacidad necesaria, no más.