Las aplicaciones de cloruro de calcio afectan al desarrollo de diversos aislados de 'Botrytis Cinerea' obtenidos de plantas ornamentales
También se midió la conidiogénesis (medida como el número de conidios producido por unidad de área micelial y el tiempo de aparición), la masa de micelio aéreo y sumergido dentro del medio de cultivo y la producción de esclerocios formados (recuento por placa). El CaCl2 aumentó el crecimiento micelial del aislado de 'H. macrophylla', desde 15 cm2/día (0 g/l) hasta 18 cm2/día (16 g/l) y lo retrasó en los aislados de 'L. camara' y 'L. japonica'. La dosis de 16 g/l de CaCl2 elevó el crecimiento del micelio aéreo de 'P. x hortorum' y la masa del micelio sumergido de 'H. macrophylla', pero no la de 'L. japonica'. La conidiogénesis se redujo con CaCl2, especialmente en el aislado de 'C. persicum' (cuatro veces más bajo que el control). Finalmente, el calcio redujo la producción de esclerocios en el aislado de 'H. macrophylla'. Esta variabilidad de respuesta entre aislados debería tenerse en consideración en las aplicaciones de calcio fundamentalmente para prevenir los ataques de hongos en poscosecha durante el transporte de plantas ornamentales en maceta.
Introducción
El calcio es un elemento mineral esencial en la constitución de las plantas. Está presente abundantemente en las paredes celulares donde tiene un papel fundamental en el fortalecimiento de su estructura. Este macronutriente forma parte también de las paredes celulares de la mayoría de los hongos y es esencial para la síntesis de la pared y el crecimiento hifal. En agricultura está presente habitualmente en todos los programas de abonado y se aplica generalmente complejado con ácidos orgánicos y aminoácidos para favorecer la asimilación y traslocación del calcio por toda la planta. Los aminoácidos, por sí mismos, actúan como activadores vegetativos consiguiendo que la posible carencia mineral se supere más rápidamente. El calcio utilizado en los bionutrientes procede generalmente del cloruro de calcio o cloruro cálcico (CaCl2). Es fácilmente asimilado por las plantas cuando se utiliza conjuntamente con ácido glucónico y aminoácidos. La utilización junto con aminoácidos previene y corrige las deficiencias cálcicas y se usan cuando es necesario potenciar algún proceso del desarrollo vegetal en cultivos que presentan síntomas carenciales, incluido los florales. Su formulación junto con boro es común, tanto para cubrir las necesidades normales del cultivo, como para prevenir o curar estados carenciales calcio-boro, tales como el acorchado ('bitter-pit') de la manzana, la necrosis marginal ('tip-burn') en fresa, la necrosis apical (peseta) del tomate, pimiento, aceituna o pepino, la caída prematura de las cápsulas de algodón, la podredumbre apical del apio, así como para superar situaciones de estrés o cuando se necesite reactivar los mecanismos de crecimiento y mejora de frutos. Ello es debido a que el boro actúa previniendo las fisiopatías atribuidas al calcio, pero en las que está reconocida una influencia del boro (De Liñán, 2009). Por otro lado, es un hecho reconocido que las aplicaciones de calcio en forma de CaCl2 son muy útiles para aumentar la resistencia natural de las frutas, hortalizas y flores a los patógenos, debido a que incrementa el contenido en calcio de las plantas y sus efectos protectores de los tejidos al hongo patógeno 'B. cinerea'. (Barkai-Golan, 2001).
El objetivo del presente trabajo fue evaluar el efecto y el grado de variabilidad que presentan los distintos aislados del hongo 'Botrytis cinerea' obtenidos de plantas ornamentales a la acción del cloruro cálcico.
Materiales y métodos

Una vez purificados todos los aislados, se hizo un estudio de caracterización presentado en Martínez et al. (2008). A partir de cada aislado se realizaron subcultivos en PDA a los que se agregaron CaCl2 a las siguientes concentraciones realizadas en el medio de cultivo: 0, 1, 2, 4, 8 y 16 g/l. Una vez solidificado el medio con CaCl2 se procedió a colocar un pequeño fragmento del aislado del hongo por placa que previamente había crecido en PDA durante cinco días. Se realizaron cinco placas (repeticiones) de aislado y dosis de CaCl2 y se incubaron durante 36 días a 26 °C en condiciones normales de luz de día y de noche. Debido a que solamente la concentración de 16 g/l mostró efectos significativos sobre los aislados, los resultados presentados corresponden a esta concentración.
El crecimiento del micelio se obtuvo a partir del área de la colonia obtenida con una cámara fotográfica digital, medida diariamente con el uso del software Image Tools 3.0 (Optika Microscopes, Barcelona). Se utilizó la tasa de crecimiento μ (cm2/día), definida como la variación de la extensión de la colonia fúngica durante un período de tiempo determinado en la fase lineal del crecimiento del hongo de acuerdo con la siguiente ecuación:
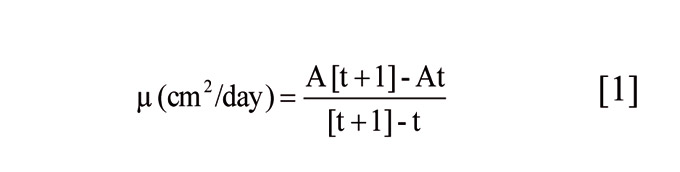
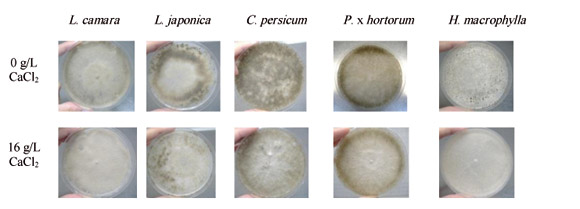
La conidiogénesis empieza cuando los conidióforos y, en consecuencia, la masa de conidios, emerge del micelio aéreo. Este proceso suele cambiar el color del hongo hacia tonos grisáceos. El número de conidios producidos por colonia se determinó a los siete días, cuando las colonias alcanzaban el tono más grisáceo. No obstante, este color no fue evidente en todos los aislados debido a la variabilidad fenotípica presente. El final de la fase lineal de crecimiento fue otra variable a tener en cuenta para medir la conidiogénesis. En este momento, las placas se congelaron a -18 °C para endurecer el medio de cultivo y separar fácilmente con un bisturí el micelio aéreo del sumergido por debajo del medio. El micelio eliminado se introdujo en una bolsa de stomacher y se añadió un volumen medido de agua destilada al que añadió tween 80 a 0,01% (v/v). Tras el homogeneizado en el stomacher (Seward Medical, Reino Unido), se midió el número de conidios en una cámara de recuento Thoma (Brand, Alemania).
El resultado se extrapoló para expresarlo en número de conidios por cm2 de hongo. La masa de micelio aéreo obtenida por el procedimiento anterior, tras la fase lineal de crecimiento, se secó en una estufa a 60 °C durante seis horas antes de su pesado en una balanza de precisión (Sartorius BP221S, Göttingen, Alemania) y los resultados se expresaron como mg micelio/placa. El micelio sumergido (micelio vegetativo que crece por dentro del medio de cultivo con el fin fundamental de obtener los nutrientes) se determinó al mismo tiempo. Para ello, el bloque sólido de medio de cultivo congelado conteniendo únicamente el micelio sumergido se llevó suavemente hasta ebullición con el fin de eliminar la mayor parte del agua. Entonces, el residuo se secó completamente en la estufa utilizando las condiciones anteriormente descritas para medir la masa del micelio aéreo. El residuo seco del medio de cultivo, que corresponde a unos 780 mg (equivalente a 20 ml de medio) fue descontado al peso seco final obtenido.
Las diferencias entre la aplicación de CaCl2 y los aislados, así como la interacción entre ellos fue valorada por un ANOVA de dos factores por medio del software Statgraphics Plus (StatPoint Inc., Herdon, VA). El factor aislado de 'Botrytis' tuvo cinco niveles (geranio, lantana, lonicera, hortensia y ciclamen), y el factor CaCl2 tuvo dos niveles (0 y 16 g/l). Se utilizó un aislado por planta y cuatro repeticiones por combinación de los dos tratamientos. Adicionalmente se utilizaron cuatro placas por tratamiento para obtener la conidiogénesis y masa hifal. Las medias de los tratamientos se separaron mediante el test del LSD.
Resultados y discusión

Sin embargo, los aislados de 'H. macrophylla' y 'L. camara', permanecieron típicamente blancos, debido a la escasa proliferación de conidios y de hifas acintadas. En general, los aislados de 'B. cinerea' mostraron un elevado grado de variabilidad en su cinética de crecimiento, dependiendo de la aplicación de CaCl2 (Tabla 2, Figs. 2 y 3). Este compuesto afectó al crecimiento del micelio durante la fase lineal de crecimiento de manera desigual según el tipo de aislado. El cloruro cálcico incrementó el crecimiento del aislado de 'H. macrophylla' desde 15 cm2/día (0 g/l) a 18 cm2/día (16 g/l) y retrasó el de los aislados de 'L. camara' y 'L. japonica' (Tabla 2, Fig. 3).
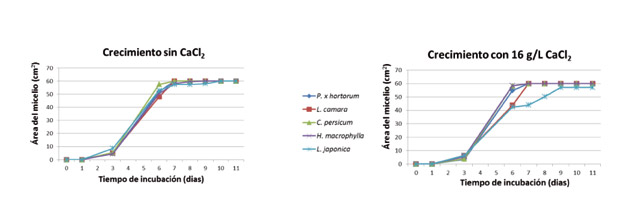
Las fases típicas de crecimiento que se presentan en un hongo cuando crece en medio de cultivo sólido sintético pudieron ser observadas (Fig. 3). Inicialmente se presentó la fase de latencia, que se caracteriza por un nulo o escaso crecimiento y que duró casi 24 horas con o sin CaCl2. Posteriormente tuvo lugar la fase exponencial, cuya duración es tan breve que raramente se llega a poner de manifiesto en los gráficos. Esta fase dura hasta que el hongo crece unos 0,1 mm. En la fase lineal se presentaron dos tasas de crecimiento distintas. Una primera en la cual el hongo creció más despacio y duró hasta el tercer día, y otra segunda que tuvo lugar entre el tercer día y el sexto. En esta fase ocurrió la mayor tasa de crecimiento en todos los aislados, tanto en presencia de CaCl2 como sin él. Posteriormente los aislados no aumentaron prácticamente la extensión de las colonias (fase de deceleración). La influencia del calcio estuvo en los aislados de 'L. camara' y de 'L. japonica' que acortó, en los dos casos, la fase lineal de crecimiento, especialmente en este último (Tabla 2, Fig. 3). Como consecuencia, el CaCl2 retrasó la velocidad de crecimiento de estos dos aislados, si bien, finalmente el tamaño fue el mismo en todos los casos (Fig. 3). La aplicación de calcio incrementó el micelio aéreo del aislado de 'P. x hortorum' y la masa del micelio sumergido del aislado de 'H. macrophylla', pero no el de 'L. japonica' (Tabla 2). El aislado de 'C. persicum' presentó la mayor masa de micelio aéreo (296 mg/placa. Tabla 2), seguido del aislado de 'P. x hortorum'. El micelio aéreo de los aislados 'H. macrophylla', 'L. camara' y 'L. japonica' fue insignificante (entre 2 y 5 mg/placa. Tabla 2). No hubo relación directa entre la masa de micelio aéreo y la masa del micelio sumergido, a excepción del aislado de 'C. persicum', que presentó también la mayor masa de micelio sumergido (Tabla 2). Este resultado parece que contrasta con el crecimiento en extensión del micelio que tuvo tendencia a ralentizarse en algunos aislados. Sin embargo, el crecimiento en extensión de un hongo no está directamente relacionado con su masa hifal necesariamente. Una elevada masa hifal acompañado de una extensión compacta implica una masa de hifas muy cortas y ramificadas.
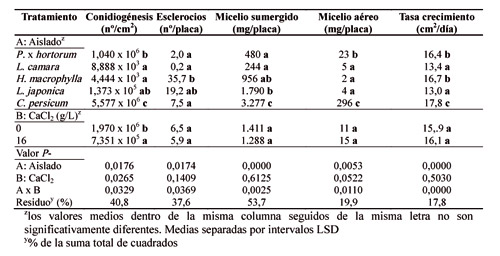
En relación a la producción de esclerocios, estos empezaron a aparecer a partir de los 14 días y a partir de los 30 días aproximadamente ya no aparecieron más. Los aislados que más esclerocios produjeron fueron los obtenidos de 'H. macrophylla', seguidos de 'L. japonica'. Es destacable que la aplicación de calcio redujo la producción de esclerocios en el aislado de 'H. macrophylla' (Tabla 2, Fig. 2). Este resultado es importante para el control de 'Botrytis blight', puesto que los esclerocios constituyen la mayor fuente de inóculo infectivo de 'B. cinerea' presente en el suelo.
Por todo ello, se concluye que los tratamientos de calcio para mejorar la resistencia de las plantas ornamentales en maceta a los ataques de 'B. cinerea', no parecen que vayan a mejorar sustancialmente la resistencia a 'Botrytis blight' cuando se busca el efecto directamente sobre el hongo. Si bien, se ha encontrado un efecto favorable a altas concentraciones en la reducción del crecimiento, producción de conidios y de esclerocios, los resultados han sido muy variables dependiendo del aislado considerado. No obstante, los efectos de la aplicación de calcio in vivo, es decir, sobre las plantas, se consideran bastante útiles para reducir la infección por medio del fortalecimiento de las paredes celulares de los vegetales y eso es un hecho constatado.
- Barkai-Golan, R. 2001. Postharvest Diseases of Fruits and Vegetables. Development and Control. Elsevier, Amsterdam, Holanda, 418 págs.
- Barnett H.L., Hunter B.B. 1999. Illustrated Genera of Imperfect Fungi (4ª ed.). APS – The American Phytopathological Society Press – St. Paul, MN, EE.UU. 218 págs.
- Beever R.S., Weeds P.L. 2004. Taxonomy and genetic variation of Botrytis and Botryotinia. En: Elad Y., Williamson B., Tudzynski P., Delen N. (eds.), Botrytis: Biology, Pathology and Control. Kluwer Academic Publishers, Dordrecht, Holanda, pp. 29-52.
- Chardonnet, C.O., Sams, C.E., Trigiano, R.N., Conway, W.S. 2000. Variability of three isolates of Botrytis cinerea affects the inhibitory effects of calcium on this fungus. Postharvest Pathogens and Mycotoxins, 90(7): 769-774.
- Daughtrey M.L., Wick R.L., Peterson J.L. 1995. Compendium of Flowering Potted Plant Diseases. APS – The American Phytopathological Society Press – St. Paul, MN, EE.UU. 90 págs.
- De Liñán, C. 2009. Vademécum de Producto Fitosanitario y Nutricionales. Ediciones Agrotécnicas, S.L., Madrid, 784 págs.
- Martínez F., Blancard D., Lecomte P., Levis C., Dubos B., Fermaud M. 2003. Phenotypic differences between vacuma and transposa subpopulations of Botrytis cinerea. European Journal of Plant Pathology, 109:479-488.
- Martínez J.A., Bañón S. 2007. Differential effects of gibberellic acid on the growth of Botrytis cinerea isolated from various ornamental plants. XVI International Plant Protection Congress, Glasgow, Escocia, Reino Unido, 15-18 octubre 2007. Congress Proceedings, 2:780-781.
- Martínez J.A., Navarro A., Fernández J.A., Bañón S. 2007. Using paclobutrazol to delay the growth of Botrytis cinerea isolated from Chamelaucium uncinatum. Australasian Plant Pathology, 36:39-45.
- Martínez, J.A., Valdés, R., Vicente, M.J., Bañón, S. 2008. Phenotypical differences among B. cinerea isolates from ornamental plants. Communications in Agricultural and Applied Biological Sciences, 73(2): 121-129.
- Martínez J.A., Gómez-Bellot M.J., Bañón S. 2009. Temperature-dependent growth of Botrytis cinerea isolates from potted plants. Communications in Agricultural and Apllied Biological Sciences, 74(3):729-738.
- Martínez J.A., Valdés R., Bañón S. 2010. Effects of paclobutrazol on Botrytis cinerea isolates obtained from potted plants. Communications in Agricultural and Apllied Biological Sciences, 75(4):709-719.
- Martínez J.A., Gómez-Bellot M.J., Bañón S. 2011a. Effects of calcium chloride on Botrytis cinerea isolates obtained from ornamental plants. International Congress of Postharvest Pathology, Lleida, Cataluña, España, 11-14 abril 2011.
- Martínez, J.A., Valdés, R., Gómz-Bellot, M.J., Bañón, S. 2011b. Effects of índole-3-acetic acid on Botrytis cinerea isolates obtained from potted plants. Communications in Agricultural and Applied Biological Sciences. En prensa.
- Rigotti S., Gindro K., Richter H., Viret O. 2002. Characterization of molecular markers for specific and sensitive detection of Botrytis cinerea Pers.: Fr. in strawberry (Fragaria x ananassa Duch.) using PCR. FEMS Microbiology Letters, 209:169-174.
- Sánchez-Blanco M.J., Navarro A., Álvarez A., Bañón S. 2009. Changes in leaf water relations, growth and flowering quality in potted geranium plants irrigated with different water regimes. Journal of Plant Physiology, 166:467-476.
- Wisniewski, M., Droby, S., Chalutz, E., Eilam, Y. 1995. Effects of Ca2+ and Mg2+ on Botrytis cinerea and Penicillium expansum in vitro and on the biocontrol activity of Candida oleophila. Plant Pathology, 44: 1016-1024.