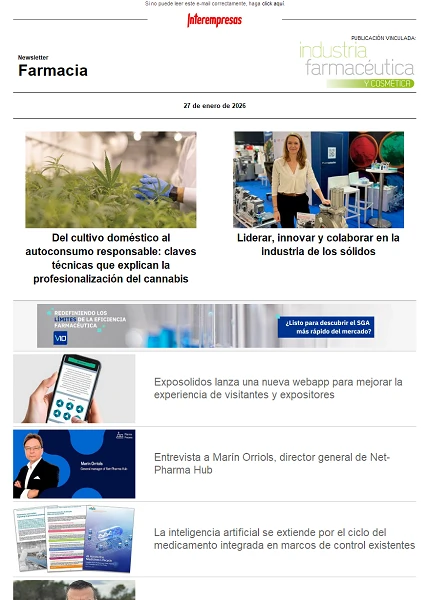
España mejora el acceso a medicamentos huérfanos, pero enfrenta retos estructurales

El acceso a los medicamentos huérfanos en España continúa mejorando, pero lo hace a un ritmo desigual y todavía condicionado por complejos procesos regulatorios y de financiación. El Informe Anual de Acceso 2025 de AELMHU ofrece una visión detallada de la evolución del sistema en la última década y plantea los principales desafíos que afronta la industria farmacéutica, las administraciones y, sobre todo, los pacientes con enfermedades raras.

El Informe Anual de Acceso a los Medicamentos Huérfanos, elaborado por la Asociación Española de Laboratorios de Medicamentos Huérfanos y Ultrahuérfanos (AELMHU), se ha consolidado como una referencia imprescindible para evaluar el grado de incorporación de estas terapias al Sistema Nacional de Salud (SNS). Su edición de 2025 vuelve a poner el foco en los tres grandes hitos del acceso: la autorización de comercialización en Europa, la obtención del Código Nacional en España y la financiación pública efectiva.
A cierre de 2025, el informe identifica 221 medicamentos huérfanos con designación vigente y nombre comercial en la Unión Europea, de los cuales 156 cuentan con autorización de comercialización comunitaria. Esta cifra confirma una tendencia creciente en la innovación dirigida a enfermedades raras, impulsada tanto por avances científicos como por los incentivos regulatorios europeos.
España ante el espejo europeo
El análisis revela que España mantiene una posición intermedia en el contexto europeo. De los medicamentos huérfanos autorizados en la UE, 134 han obtenido Código Nacional, paso indispensable para su comercialización en el país. Sin embargo, el dato clave se sitúa en la financiación: 103 medicamentos están actualmente financiados por el SNS, lo que equivale al 66% de los medicamentos huérfanos con autorización de comercialización y a más del 75% de aquellos que ya disponen de Código Nacional.
Desde la perspectiva de la industria farmacéutica, estas cifras reflejan una mejora progresiva, pero también ponen de manifiesto un recorrido aún incompleto entre la innovación y el acceso real del paciente. La diferencia entre medicamentos autorizados y financiados sigue siendo uno de los principales indicadores de tensión del sistema.
Una evolución positiva, pero no homogénea
El informe muestra que, en los últimos diez años, los tres indicadores analizados han evolucionado al alza, aunque de forma desigual. La autorización de comercialización en Europa continúa creciendo de manera sostenida, impulsada por el desarrollo de nuevas moléculas, terapias génicas y tratamientos altamente especializados.
No obstante, el porcentaje de medicamentos que logran completar todo el itinerario hasta la financiación pública en España sigue siendo inferior al deseable. La obtención del Código Nacional se mantiene en torno al 86% de los medicamentos autorizados en la UE, una cifra estable, pero que refleja un cierto estancamiento respecto a ejercicios anteriores.
El factor tiempo: el gran desafío pendiente
Más allá del número de medicamentos disponibles, el informe subraya un aspecto crítico para los pacientes y para la industria: los tiempos de acceso. Aunque el resumen ejecutivo no fija un único promedio, sí señala que los plazos entre la autorización europea, la asignación del Código Nacional y la decisión de financiación continúan siendo prolongados y variables.
Para los laboratorios, estos tiempos suponen incertidumbre regulatoria y financiera; para los pacientes con enfermedades raras, implican retrasos que pueden resultar determinantes en patologías graves, progresivas o sin alternativas terapéuticas. En este contexto, la agilidad administrativa se consolida como uno de los grandes retos del sistema sanitario español.
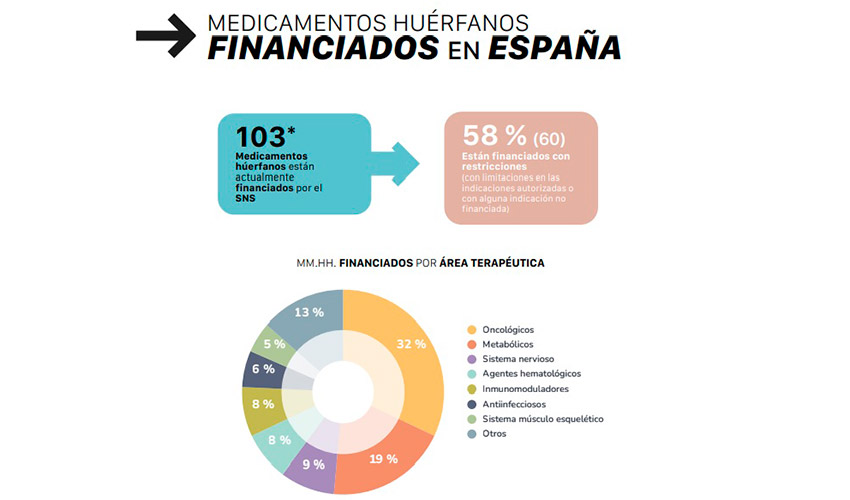
Terapias avanzadas: innovación con reglas propias
El informe dedica especial atención a las terapias avanzadas dirigidas a enfermedades raras, un segmento en plena expansión. Estas terapias, que incluyen tratamientos génicos y celulares, representan uno de los mayores saltos cualitativos en la innovación farmacéutica reciente, pero también plantean desafíos específicos en términos de evaluación clínica, precio y modelos de financiación.
AELMHU destaca la necesidad de marcos regulatorios y económicos adaptados a estas terapias, capaces de equilibrar la sostenibilidad del sistema con el acceso temprano a innovaciones potencialmente transformadoras.
Medicamentos que pierden la designación huérfana
Otro de los puntos analizados es la situación de los medicamentos que han perdido la designación huérfana tras su autorización. Estos productos, aunque ya no cuentan con el estatus regulatorio específico, siguen siendo esenciales para determinados pacientes y requieren mecanismos claros que garanticen su continuidad en el SNS, evitando desigualdades en el acceso.
Recomendaciones para un acceso más predecible
El informe concluye con una serie de recomendaciones dirigidas a los decisores públicos y a los agentes del sistema sanitario. Entre ellas destacan la simplificación de los procedimientos, una mayor transparencia en los criterios de financiación, la coordinación temprana entre reguladores, financiadores e industria, y la adopción de modelos de evaluación más flexibles y adaptativos.
Estas propuestas apuntan a un objetivo común: convertir la innovación farmacéutica en un beneficio tangible y oportuno para los pacientes, sin comprometer la sostenibilidad del sistema.