Conversión fotoquímica del CO2 en productos combustibles
1 de junio de 2009
El último informe del IPPC presenta un panorama devastador para el medio ambiente y la economía del planeta, a menos que se tomen acciones decididas para frenar el cambio climático. También nos informa de que para mantener nuestro clima a salvo es necesario recortar globalmente las emisiones de CO2 entre el 50% y el 85% a mediados de siglo. En cuanto a la mejor estrategia para resolver el problema, se apuesta por una solución multidimensional que combine diversas acciones: usar la energía de forma mucho más eficiente en todos los sectores, y, al mismo tiempo, reducir la deforestación y desarrollar las tecnologías necesarias para obtener energía de fuentes alternativas, bajas en emisiones, en especial de las renovables, como la solar y la eólica. No obstante lo anterior, se espera que los combustibles fósiles sigan siendo el pilar de la producción energética mundial durante el presente siglo. Aún así, se podría hacer frente a la creciente demanda energética y, a la vez, reducir las emisiones de CO2, si fuera posible dotar a las plantas de combustibles fósiles con tecnología de captura y almacenamiento de CO2. En otras palabras, junto al freno a la deforestación, la mejora de la eficiencia energética y el desarrollo de las energías renovables, las tecnologías de captura y almacenamiento de CO2 constituyen la cuarta vía para la reducción de los gases de efecto invernadero.
Tecnologías de captura y almacenamiento de CO2
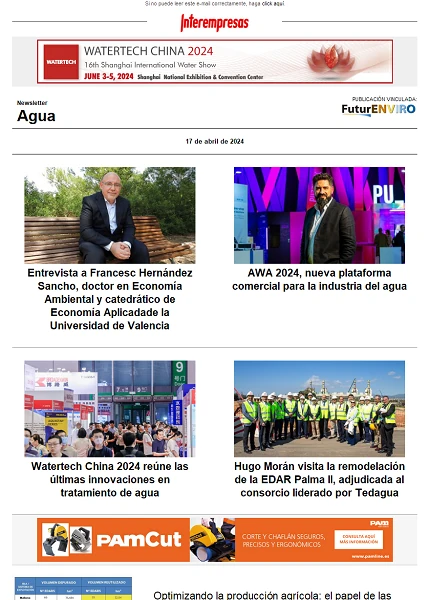
Las tecnologías de captura y almacenamiento de CO2 constituyen la cuarta vía para abordar la reducción de los gases de efecto invernadero. El freno de la deforestación, la mejora de la eficiencia energética y el desarrollo de las energías renovables son las otras tres alternativas que comúnmente se manejan para resolver el problema (Figura 1).
Si nos centramos en la captura y el almacenamiento, se puede afirmar que actualmente existe la tecnología para la captura directa y separación de CO2 en las fuentes que generan las emisiones. Sin embargo, es cara porque la concentración de CO2 en dichas emisiones no es lo suficientemente elevada. Así, las refinerías separan el CO2 para producir hidrógeno y, desde los años 70 del siglo pasado, la industria petrolífera inyecta CO2 en el subsuelo, una vez comprimido y llevado a unas condiciones de elevada pureza, para conseguir movilizar el petróleo más difícil de extraer. Por tanto, el desafío consiste en aumentar esa concentración para que el almacenamiento sea económicamente viable.
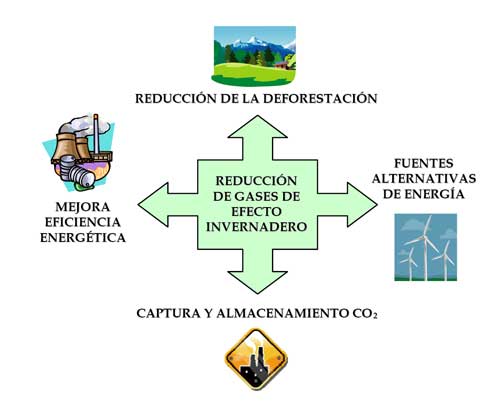
Aunque existen diversos métodos para la captura de CO2 (absorción, adsorción y procesos de membrana), se considera que la absorción del gas mediante disoluciones no acuosas de aminas es el método más apropiado (Figura 2). En la bibliografía se recogen numerosos trabajos de absorción con mono-etanol-amina (MEA) y nuevos absorbentes basados en otras aminas y sus mezclas. En la mayoría de ellos se alcanzan rendimientos aceptables de captura (Abu-Zahra y col., 2007).
Además, para aumentar la eficacia del proceso de absorción, aparte de mejoras en el diseño de los sistemas de contacto, recientemente se ha propuesto una tecnología que combina el proceso de absorción (con aminas) con el uso de membranas inorgánicas de fibra hueca. En este proceso la membrana sólo permite el paso de CO2 de la fase gaseosa a la fase absorbente y se consigue una mejora sustancial con respecto al proceso de absorción convencional (Van Loo y col., 2007).
Otro de los procesos empleados en la captura de CO2 es la adsorción del gas sobre distintos materiales, empleándose tanto arcillas (caolinita, dolomita, antracita, etc.) como materiales sintéticos (carbón activado, resinas, zeolitas, etc.). Sin embargo, parece que el potencial de esta tecnología, también clásica y bien conocida, no es competitivo frente a la absorción. Del mismo modo que tampoco lo son los procesos de membrana, una tecnología de separación de CO2 todavía emergente (Chaffee y col., 2007).
Se debe señalar que la disminución de las emisiones puede lograrse no sólo después de la combustión (mediante la comentada separación del CO2 del gas de combustión por absorción, adsorción o procesos de membrana) sino también actuando antes (transformando el combustible antes de su combustión en otro con menor proporción de C), o durante la misma (usando oxígeno en vez de aire para la combustión se obtiene una corriente más concentrada en CO2 que puede ser capturado con mayor eficacia) (USDOE, 2006).
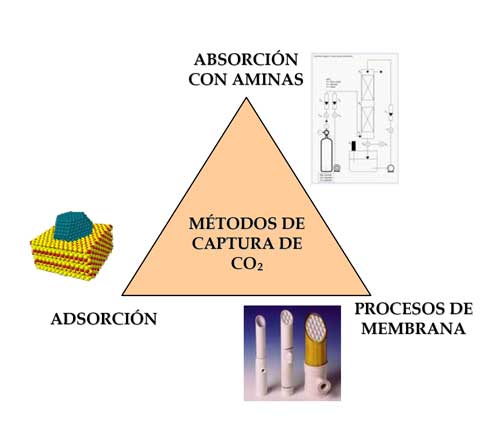
Después de la captura y separación del CO2 es necesario su almacenamiento, que puede hacerse en depósitos subterráneos (pozos agotados de gas y petróleo, depósitos salinos profundos, minas de carbón de difícil explotación, etc.), sumideros terrestres (bosques, cultivos, tierras pantanosas) y océanos (USDOE, 2006; Reiche y col., 2007).
En principio, el almacenamiento de CO2 en las formaciones subterráneas anteriores sería posible porque tienen capacidad, estructura, porosidad y otras propiedades necesarias para poder almacenarlo durante décadas o siglos (Figura 3). Sin embargo, frenan su desarrollo y expansión algunos interrogantes relacionados con su seguridad y aceptabilidad medioambiental, como, por ejemplo, asegurar que el CO2 no escapará de esas formaciones, ni migrará a la superficie de la tierra, ni contaminará las fuentes de agua potable.
En el almacenamiento terrestre (por ejemplo en bosques, terrenos agrícolas o pantanos) los ecosistemas se mantienen, mejoran o manipulan para almacenar CO2 más allá de las condiciones normales. Sin embargo, se considera improbable que los sistemas naturales mejorados sean capaces de fijar todo el CO2 emitido dada la velocidad a la que se genera actualmente.
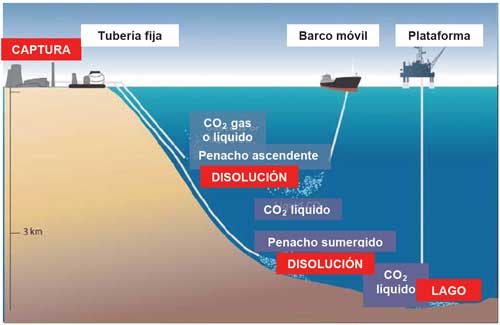
En cuanto a la capacidad de almacenamiento de los océanos, decir que puede ser importante y que ya se están haciendo experimentos para determinar su eventual utilización, tanto mediante inyección directa como estimulando su capacidad natural de absorción mediante el uso de fertilizantes (USDOE, 2006). Las investigaciones van dirigidas fundamentalmente a determinar la efectividad de las operaciones y el impacto ecológico resultante, así como a asegurar la aceptabilidad medioambiental de los procedimientos. Se sabe que pequeños cambios en los ciclos biogeoquímicos pueden tener grandes consecuencias, muchas de ellas secundarias y difíciles de predecir, siendo de particular preocupación la acidificación de las aguas oceánicas. En la Figura 4 se muestran diferentes métodos de almacenamiento de CO2 en el océano.
En definitiva, podemos concluir que la captura, transporte y almacenamiento de CO2 presenta ciertos inconvenientes. Aparte de incrementar el coste de producción energética en un 30% (Zero Emission Platform, 2007; OSTI, 2007), implica gasto de energía adicional, con sus correspondientes emisiones de CO2, exige acondicionamiento de los lugares de almacenamiento y, además, existen incógnitas sobre la seguridad definitiva de los mismos.
Conversión del CO2
Una alternativa a los procedimientos anteriores es su conversión, química o biológica, en productos inertes y estables, que pueden ser comerciales o no (RSC, 2006). Esta es una opción con garantías, pues en la naturaleza existen muchos ejemplos de conversión del CO2 como, por ejemplo, la fotosíntesis y las reacciones del gas con minerales para formar carbonatos.
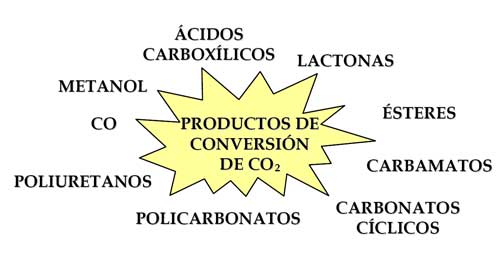
Debe destacarse que aunque la molécula de CO2 es muy estable, y consecuentemente sus procesos de conversión lentos, el potencial para la transformación química es inmenso. Aunque con rendimiento cuestionable, la tecnología actual permite convertirlo en productos químicos convencionales, polímeros, combustibles, etc. (Figura 5). Sin embargo, considerando que, en términos de carbono equivalente, la industria química sólo puede absorber del 1 al 3 % de las emisiones antropogénicas de CO2 (RSC, 2006), la síntesis de combustibles se presenta como la única vía de conversión que realmente puede tener un impacto significativo sobre la reducción de las emisiones.
En este contexto de reutilización de CO2 para producir un nuevo combustible merecen especial consideración las reacciones de gasificación del carbón (C + CO2 + 171 kJ → 2 CO), reformado catalítico de CH4 para producir gas de síntesis (CH4 + CO2 + 247 kJ → 2 CO + 2 H2), o la fotosíntesis mejorada (6 CO2 + 6 H2O + energía → C6H12O6 + 6 O2) (Edwards, 1995). Su principal problema es que requieren el aporte de gran cantidad de energía. Por tanto, desde el punto de vista de la reducción de las emisiones, lo ideal sería usar fuentes de energía alternativas a los combustibles fósiles, como las renovables. En ese caso, el proceso supondría la transformación de una energía difícilmente almacenable o transportable (viento, radiación solar) en un combustible líquido o gaseoso que puede utilizarse en sistemas convencionales de producción de electricidad o calor.
Obviamente, al igual que la captura y el almacenamiento, esta tecnología va dirigida a grandes plantas de producción de energía eléctrica y otras industrias en las que la cantidad de CO2 generado es considerable y está concentrado, quedando excluido en principio el sector de los transportes, que consta de multitud de pequeñas fuentes móviles.
En particular, la reproducción en el laboratorio de la fotosíntesis mediante procesos fotocatalíticos es el objetivo del Proyecto ELCAT (Centi, 2006; ELCAT, 2007), financiado por la Unión Europea, y en el que colaboran institutos de investigación y universidades de Francia, Italia, Alemania y Grecia. Actualmente los investigadores de este proyecto logran obtener hidrocarburos de cadena corta con una eficiencia del 1 % (eficiencia de la fotosíntesis 3-5 %). Además, consideran que en el futuro el proceso podría ser viable a escala industrial si se resuelven sus principales problemas: la eficiencia del proceso es baja y su cinética lenta.
Ambos aspectos se podrían mejorar mediante el desarrollo de catalizadores más eficaces que los actuales y abordando nuevos diseños de reactores (Alexiadis y Mazarino, 2005; Song, 2006; Usubharatana y col., 2006).
Dado que para abordar con éxito las mejoras apuntadas es necesario conocer, tanto los principios que gobiernan los procesos fotocatalíticos, como su aplicación a la captura del CO2 presente en los gases emitidos en la combustión de combustibles fósiles, ambos aspectos se revisarán brevemente a continuación.
Reducción fotocatalítica de CO2
Los métodos fotocatalíticos implican usar semiconductores para provocar reacciones en presencia de luz. A diferencia de los metales, que muestran un continuo de estados electrónicos, cuando los semiconductores se exponen a la acción de la luz presentan una región energéticamente prohibida, que se extiende desde la parte superior de la banda de valencia a la inferior de la banda de conducción (Figura 6a).
Las ecuaciones siguientes describen la generación de pares electrón-hueco o fotoexcitación (e- - h+) y el proceso inverso:
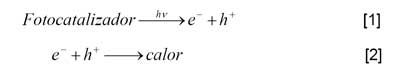
donde hν es la energía del fotón, e- representa un electrón en la banda de conducción y h+ un hueco en la banda de valencia.
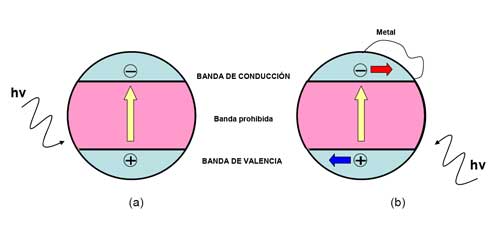
La vida del par electrón excitado-hueco es muy corta, de sólo unos cuantos nanosegundos (Bussi y col., 2002), pero suficiente para provocar la reacción rédox. En la Figura 6a también se ilustra el salto de un electrón, desde la banda de valencia a la banda de conducción, excitado por una radiación luminosa con energía igual o superior a la región prohibida del semiconductor. El electrón (e-) y el hueco (h+) formados migran separadamente hacia la superficie del conductor. Una vez los electrones alcancen la superficie, ocurrirá la transferencia fotoinducida de electrones a las moléculas próximas, que pueden estar adsorbidas o no al semiconductor, pero que será más eficiente si lo están (Linsebigler, 1995). Si se trata de los huecos, éstos al llegar a la superficie pueden combinarse con los electrones de especies donantes. La velocidad a la que ocurre la transferencia de carga depende de la magnitud de la banda prohibida y del potencial rédox de las especies adsorbidas. A veces los electrones y los huecos formados pueden recombinarse antes de alcanzar la superficie del semiconductor, fenómeno que impediría su reacción con las moléculas adsorbidas.
De un modo general, puede afirmarse que los procesos fotocatalíticos ocurrirán en condiciones óptimas si: 1) El potencial rédox del hueco fotogenerado en la banda de valencia es lo suficientemente positivo como para actuar como aceptor de electrones; 2) El potencial rédox del electrón fotogenerado en la banda de conducción es lo suficientemente negativo como para actuar como donante.
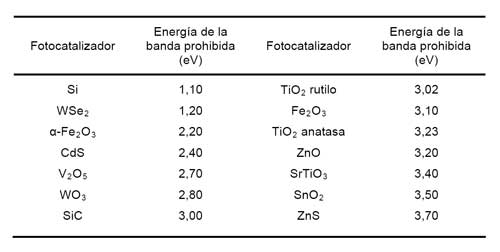
Kabra y col. (2004) suministran información sobre la magnitud de la banda prohibida de los semiconductores usados habitualmente en procesos fotocatalíticos (Tabla 1).
Comparada con la reducción química, la reducción fotocatalítica del CO2 ocurre en condiciones relativamente suaves, con menor consumo energético. Es así porque, debido a que el CO2 es un compuesto relativamente inerte y estable, la primera requiere gran cantidad de energía para alcanzar las condiciones de presión y/o temperatura necesarias para la reacción (Kohno y col., 1999).
Los primeros trabajos sobre la reducción fotocatalítica de CO2 en disolución acuosa fueron publicados entre 1978 y 1979 (Halmann, 1978; Inoue y col., 1979). Después, numerosos investigadores (Hemminger y col., 1978; Chandrasekaran y Thomas, 1983; Halmann y col., 1984; Tennakone, 1984; Tennakone y col., 1989; Subrahmanyam y col., 1999) han estudiado el mecanismo y la eficiencia del proceso usando diferentes catalizadores (óxidos de titanio, zinc y cadmio, sulfuro de cadmio, carburo de silicio), reductores (agua, aminas, alcoholes) y fuentes de luz (lámparas de xenón, mercurio, halógenas). Estos trabajos han mostrado que mediante el uso de semiconductores y reductores específicos pueden obtenerse gran variedad de productos (metano, metanol, formol, ácido fórmico, etanol, etano, etc.).
El efecto de la presión se ha investigado en varios trabajos (Hara y col., 1995; Mizuno y col., 1996; Kaneko y col., 1998; Hori y col., 2003) utilizando agua y disolventes orgánicos como sustancias reductoras y, generalmente, TiO2 como catalizador. Se ha encontrado que la conversión del CO2 aumenta al hacerlo la presión y que la selectividad también depende de esta variable, principalmente debido a la distinta variación de la velocidad de adsorción de las especies reaccionantes al aumentar la presión.
En cuanto al efecto de la temperatura, se debe señalar que, aunque en fotocatálisis la irradiación fotónica es generalmente la fuente de energía primaria para la formación del par electrón-hueco a temperatura ambiente (porque el salto energético de la banda prohibida es demasiado grande como para ser superado mediante excitación térmica), a altas temperaturas la velocidad de reacción puede aumentar debido a que también lo hacen la frecuencia de las colisiones y las velocidades de difusión.
En general se ha encontrado que la velocidad de la reacción global aumenta con valores crecientes de la variable, probablemente debido a que la mayor temperatura activa las etapas térmicas, como por ejemplo la desorción, que siguen a la reacción fotoquímica (Saladin y Alxneit, 1997). A pesar de ello, en algunas referencias se informa del efecto negativo de las altas temperaturas sobre el tiempo de vida de los estados excitados originados tras la fotoexcitación, llegándose incluso a desactivar el proceso. Por otra parte, Fox y Dulay (1993) encontraron que, como la mayoría de las reacciones, las fotocatalíticas no son sensibles a pequeñas variaciones de la temperatura.
También se ha analizado el efecto de distintas sustancias reductoras sobre el mecanismo y la selectividad de la reacción. La fotorreducción del CO2 con agua es barata y relativamente sencilla. Sin embargo, plantea ciertos problemas derivados de la baja solubilidad del CO2 en ella y de la existencia de reacciones competitivas, también consumidoras de H+ y e-, que conducen a la formación de H2 y H2O2 en detrimento de la formación de productos de reacción del CO2 (ácido fórmico, formaldehído, metanol, metano, CO, etc.). Por todo ello, se ha encontrado que, en general, cuando se usa agua los rendimientos de productos orgánicos son bajos (Usubharatana, 2006).
Para superar estas limitaciones algunos investigadores han sustituido el agua por otras sustancias reductoras (trimetil-amina, trietanol-amina, dimetil formamida y alcohol isopropílico). Han observado que la polaridad de los disolventes tiene una influencia significativa sobre el mecanismo de la reacción y que el empleo de disolventes orgánicos mejora la eficiencia y la selectividad del proceso hacia los productos deseados (Liu y col., 1998).
También para evitar los inconvenientes anteriores, la fotorreducción se ha llevado a cabo con gases como el sulfhídrico (Aliwi y Aljubori, 1989), hidrógeno (Kohno y col., 1997; Kohno y col., 2000; Guan y col., 2003) y metano (Anpo y col., 1997). Incluso se ha analizado la reducción fotocatalítica del CO2 supercrítico, en ausencia de sustancias reductoras, y usando catalizadores de TiO2 e irradiación mediante lámpara de xenón (Kaneko y col., 1999). En este último trabajo no se identificaron productos gaseosos reducidos después de la irradiación, pero el lavado con agua del catalizador tras la irradiación permitió observar la presencia de ácido fórmico (originado tras la protonación ocurrida al añadir agua a los intermedios de la reacción adsorbidos en el catalizador, es decir, de los radicales aniónicos · CO2-). Por otra parte, se encontró que, si el lavado se realizaba con disoluciones ácidas (metanol, etanol, propanol y ácidos nítrico, clorhídrico y fosfórico) en vez de con agua, la cantidad de fórmico producido aumentaba con el pH de la disolución, debido probablemente a que la mayor disponibilidad de H+ favorecía la desorción de los intermedios de la superficie del catalizador.
Fotocatalizadores
En cuanto a las propiedades de los potenciales catalizadores del proceso, destacar como más importantes que deben ser materiales semiconductores con una amplia banda prohibida, ya que ello se traduce en altos potenciales rédox negativos y positivos en las bandas de conducción y de valencia, respectivamente. La desventaja de una gran amplitud de la banda prohibida es que los semiconductores necesitan un aporte energético mayor pero, desde el punto de vista de la fotocatálisis, éste es un problema menor. Asimismo, los materiales deben ser estables frente a la corrosión, no tóxicos, de bajo coste y con características físico-químicas que les permitan actuar como catalizadores.
Aunque se han empleado gran variedad de semiconductores, como el TiO2, ZnO, ZrO2, CdS, MoS2, Fe2O3, WO3, etc. y algunas de sus combinaciones (Tseng y col., 2002; Hori y col., 2003; Shi y col., 2004; Teramura y col., 2004; Slamet y col., 2005; Li y col., 2008), se ha observado que el que presenta un mejor comportamiento fotocatalítico y rendimiento cuántico es el TiO2, siendo, a su vez, la forma alotrópica anatasa del TiO2 más activa que la forma rutilo, debido a su mayor superficie específica y mayor densidad de centros activos para la adsorción y catálisis (Usubharatana y col., 2006).
Se ha indicado antes que para que ocurra la reducción fotocatalítica es imprescindible la formación de pares electrón-hueco tras la absorción por el semiconductor de fotones procedentes de una fuente de luz. Sin embargo, a veces puede ocurrir la recombinación de los pares electrón-hueco y, en esos casos, disminuye la eficacia del proceso de fotorreducción. Es por ello que diversos autores (Hirano y col., 1992; Ishitani y col., 1993; Matsuoka y Anpo, 2003; Shi y col., 2004; Tseng y col., 2004; Sasirekha y col., 2006; Kitano y col., 2007) han analizado la posibilidad de mejorar la eficiencia y la selectividad del fotocatalizador mediante la modificación de su superficie con metales (Cu, Pt, Pd, Rh, Au, Ag y Ru).
De los trabajos anteriores se puede concluir que el dopaje metálico evita la recombinación y, en consecuencia, alarga el tiempo de vida independiente de los electrones y los huecos. En ellos también se ha observado que cuando se introduce un metal la eficiencia aumenta siempre, con independencia del metal usado, y que la selectividad hacia determinados compuestos varía con el metal empleado, aumentado sobre todo la producción de formaldehído, metanol y metano, que consumen más electrones. Esto es debido a que, como el metal y la superficie del semiconductor están en contacto, los electrones fluyen con facilidad desde el semiconductor al metal y se distribuyen en su superficie (Figura 6b). A la vez, los huecos tienen libertad para desplazarse hacia la superficie del semiconductor, donde puede tener lugar la oxidación de las especies. No obstante, la carga metálica debe optimizarse y distribuirse uniformemente sobre la superficie del catalizador. Un exceso de la misma conlleva una disminución de la superficie iluminada del catalizador y, en ese caso, los fotones no serán absorbidos como consecuencia de su reflexión.
En cuanto a la incorporación del metal al semiconductor, se ha hecho por impregnación, electrodeposición de spray (técnica ESSD) o intercambio iónico.
Otro factor que puede afectar de manera importante al proceso es el modo en el que se utiliza el catalizador, en forma pulverizada o inmovilizado sobre un soporte. Las investigaciones llevadas a cabo muestran que, en general, usados del primer modo son más eficientes debido a su mayor superficie activa y condiciones más favorables para la transferencia de materia (Ray y Beenackers, 1997; Ollis y Turchi, 1999; Cassano y Alfano, 2000).
Sin embargo, la aplicación a escala industrial de la primera opción presenta una dificultad intrínseca, la necesidad de incluir una etapa de separación de las pequeñas partículas de catalizador tras la fotocatálisis. Es por ello que el desarrollo de catalizadores soportados, eficientes y de bajo coste, se ha presentado como una alternativa que merece especial consideración (Cassano y Alfano, 2000). El mayor tamaño de partícula del catalizador soportado facilitaría la separación sólido-fluido tras la reacción fotocatalítica.
Por otra parte, en ambos casos se ha encontrado que la actividad del catalizador aumenta al disminuir el tamaño de partícula (Yamashita y col., 1994; Yoneyama, 1997) y, en el caso de los soportados, que la reactividad y la selectividad hacia un determinado producto aumentan al hacerlo el grado de dispersión del semiconductor sobre el soporte (Yamashita y col., 1998).
En relación a los catalizadores soportados, es ampliamente aceptado (Pozzo y col., 1997) que un buen material de soporte para un fotocatalizador debe poseer las siguientes características: (a) transparencia a la radiación luminosa, (b) favorecer la formación de fuertes enlaces con las partículas de catalizador sin que ello afecte negativamente a su reactividad, (c) poseer una gran superficie específica, (d) tener una alta capacidad de adsorción de la especie a degradar, (e) permitir diseños del reactor que faciliten la transferencia de materia y (f) ser químicamente inerte.
Debido a que satisfacen los requisitos anteriores, los soportes más utilizados han sido materiales silíceos como microesferas de sílice no porosa, gel de sílice, cuarzo, vidrio, etc. Mención especial merecen los silicatos y aluminosilicatos con estructuras zeolíticas debido a sus características singulares relativas al tamaño de poro, topología de la superficie interna y capacidad de intercambio iónico (Anpo y col., 1997; Zhang y col., 1997; Anpo y col., 1998; Yamashita y col., 1998; Ikeue y col., 2001; Hirose y col., 2003; Shioya y col., 2003; Chun y col., 2004).
Desde el punto de vista del recubrimiento, la situación ideal ocurre cuando se dan dos condiciones básicas: (1) buena adherencia entre el catalizador y el soporte y (b) ausencia de degradación del catalizador durante el proceso de fijación (Alexiadis y Mazarino, 2005).
La primera condición es esencial, ya que la unión catalizador-soporte debe resistir las tensiones derivadas de las interacciones mecánicas partícula-partícula y partícula-fluido que se dan en el reactor y evitar, de ese modo, tanto el desgaste de las partículas del catalizador, como su desprendimiento del soporte.
En cuanto a la segunda condición, la modificación de la actividad catalítica es de capital importancia. Puede ocurrir debido a factores como: (a) cambios en los niveles energéticos de las bandas de valencia y de conducción por la formación de enlaces catalizador-soporte y/o por el pequeño tamaño de partícula del recubrimiento, (b) alteración de la estructura cristalina del catalizador como consecuencia del tratamiento de fijación a temperaturas relativamente altas, (c) disminución del área superficial del catalizador debido a la aglomeración de partículas del mismo y a los enlaces catalizador-soporte y (d) fijación de las partículas de catalizador en los microporos internos del soporte donde no puede penetrar la luz.
La fijación del catalizador sobre el soporte se ha llevado a cabo principalmente por dos métodos (Pozzo y col., 1997). En uno de ellos se realiza la fijación del catalizador sobre el soporte después de haber sintetizado el primero. El otro se basa en la generación in situ del catalizador mediante los procesos sol-gel, SGP (Tseng y col., 2002), o de deposición química de vapor, CVD (Shi y col., 2004).
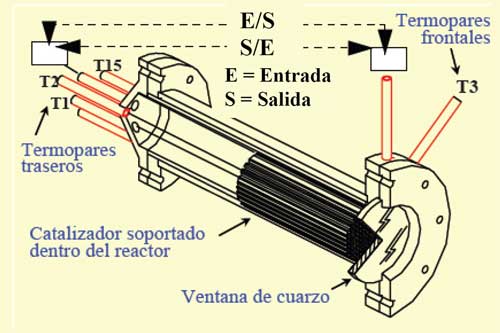
Finalmente, comentar que prácticamente no se ha estudiado el efecto de usar diferentes tipos de reactores sobre la fotorreducción del CO2 y que la mayor parte de los estudios realizados se han llevado a cabo en reactores discontinuos. En cambio, sí se ha analizado con profusión el diseño de reactores fotocatalíticos para el tratamiento de aguas siendo los de lecho fijo (Figura 7) y fluidizado los más estudiados (McCabe y col., 1993; Larson y col., 1995; Hossain y col., 1999; Alfano y col., 2000; Zhao y Yang, 2003; Yang y col., 2008).
Con relación a los reactores fotocatalíticos, se debe mencionar también que un tipo especial lo constituyen los reactores solares (Alfano y col., 2000). Para su diseño deben tenerse en cuenta dos opciones: (a) usar sistemas inmovilizados o no sobre un soporte y (b) concentrar o no la luz solar. Al igual que los reactores no solares, la ventaja de los sistemas soportados es que simplifican la etapa de separación de catalizador tras la reacción fotocatalítica. La desventaja es que suelen ser menos eficaces que los primeros. En cuanto a los sistemas que concentran o no la luz, los últimos usan tanto luz UV difusa como los rayos solares directos y, además, capturan la luz de modo más eficiente. Sin embargo, su volumen es mucho mayor que el de los primeros para una superficie equivalente de captación de energía luminosa.
A modo de conclusión puede decirse que la reducción fotocatalítica del CO2 es una tecnología alternativa e innovadora para disminuir las emisiones de CO2 a la atmósfera y que, aunque todavía se encuentra en fase de investigación, constituye un proceso de reducción de CO2 que debe ser analizado en mayor profundidad de cara a establecer su viabilidad económica futura.