Aplicación de fungicidas en plantas de vid de vivero
10 de enero de 2011
Introducción
Desde el año 2001 se ha hecho más importante la búsqueda de nuevos métodos de lucha que remplacen satisfactoriamente la prohibición del único producto eficaz contra las enfermedades de madera y que permitía mantener la viabilidad de la plantación con un buen nivel de producción y de longevidad de las plantas.
Los estudios de nuevas plantaciones de viñedos realizados en España, Francia, Portugal y en otros países vitivinícolas ponen de manifiesto la asociación entre la existencia de hongos en el tronco y el declive de viñas jóvenes, sugiriendo la existencia de una conexión entre la presencia de estos hongos en los viveros y las enfermedades de las plantas. Esto conlleva una implicación económica importante para el sector vitícola (Rego y col., 2006; Waite y col., 2007; Graham y col., 2007). Para reducir y mitigar el daño y consecuentemente las perdidas económicas es importante prevenir su transmisión en los viveros de plantas-injertos.
Las enfermedades de madera aún son lesiones mal conocidas y por ello el campo de estudio es aún muy amplio y debe ser abordado a distintos niveles. Uno de los objetivos de la lucha contra las enfermedades de madera en la planta es impedir la penetración de los hongos asociados con estas alteraciones, evitar su desarrollo en los tejidos leñosos o conseguir la eliminación de los inóculos. Los métodos de lucha abordan acciones en distintas direcciones, unas a nivel de los viveros y otras en los viñedos directamente en la planta. Además, también es necesario testar productos y métodos eficaces contra las enfermedades de madera, así como desarrollar técnicas de detección rápida de los hongos implicados.
En los viveros, algunos hongos contaminan las plantas-injerto a lo largo de su producción, siendo las etapas claves de contaminación la rehidratación y la estratificación debido a las heridas efectuadas durante el injerto, el corte o el desyemado. La estratificación se desarrolla en condiciones muy húmedas y a temperaturas altas, necesarias para inducir la callogénesis pero que igualmente resultan favorables para el desarrollo de los hongos. Otros hongos infectan las plantas después de su plantación en el campo, estas contaminaciones son probablemente debidas a inóculos situados en la superficie del material vegetal.
Objetivos
El objetivo de este trabajo fue determinar el método óptimo de aplicación de fungicidas en plantas de vivero de vid para su posterior utilización en el control de las enfermedades de madera de la vid.
Marco teórico
La prohibición de los tratamientos con arsenito sódico en el viñedo ha obligado al empleo de fungicidas que son menos eficaces (Chiarappa, 2000; Graniti y col., 2000) haciendo que los ataques o afecciones de hongos de madera en vid sea mas frecuente. Así se ha incrementado notablemente las muestras estudiadas tanto en el Laboratorio Nacional de Referencia para la Identificación de Hongos Fitopatógenos, como en el Laboratorio de Sanidad Vegetal en Cataluña (Armengol y col., 2001) y el control de muchas de estas enfermedades actualmente esta aún sin resolver (Dubos, 2002; Larignon, 2007).
Materiales y métodos
a. Material vegetal
Se emplearon cultivares de Vitis vinifera\1CV\2 Syrah injertados con el patrón 110 Richte producidos en el Vivero Navarrid. Dicho vivero posee el Título de Productor Multiplicador de Plantas de Vivero de Vid y está inscrito en el Registro de Viveros de Vid en Navarra. Las parcelas dedicadas a multiplicación y crianza de plantas y las instalaciones auxiliares se encuentran situadas en la localidad de Larraga (Navarra).
b. Fungicidas
Se han utilizado cuatro fungicidas: Cabrio Top, Signum, TaloSint y Maypon.
c. Método de inmersión lenta
La inmersión durante 36 horas se realizó en el momento de la rehidratación de las estacas, y del injerto, antes de la injertación. Se adiciona directamente el fungicida al agua de las cubetas de rehidratación resultando de fácil manejo para el viverista. Por otro lado la dosificación es de menor concentración, lo que supone un ahorro, ya que los productos no se degradan por estar en contacto con las plantas, si se debe ser cuidadoso con la limpieza, no teniendo límite si se mantiene la concentración, cuando aumentamos más producto.
d. Método de inmersión rápida
La inmersión durante 10 segundos se realizó posterior al proceso de rehidratación y antes de realizar el injerto. Supone la adición de una etapa mas en el proceso de producción ya que se realiza una inmersión muy rápida. Por otro lado la dosificación es de mayor concentración ya que se requiere tratar en segundos, desinfectar y adherir al material vegetal. Por ello, tanto la adherencia como su penetración deben de ser muy eficaces.
e. Método de pulverización
Consiste en tratar los injertos tras hacerlos y al final de poner a remojo el material vegetal. Este método de aplicación puede ser muy interesante por su comodidad, si bien hay que hacer un trabajo especial o un trabajo más, no así en el método de inmersión 36 horas que solo hay que añadir a las cubetas de rehidratación los productos que se desean aplicar. El producto tiene que tener buena adherencia al material vegetal, ya que por muy bien que se haga la pulverización y la dosificación puede que no se aplique de forma uniforme y no obtengamos la eficacia que deseamos.
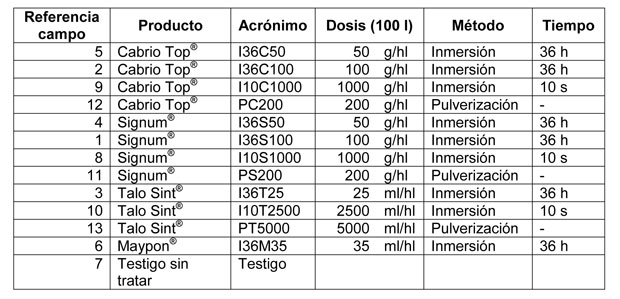
La aplicación se realizó antes de la injertación en las inmersiones y después de la injertación en la pulverización. Las dosis y los métodos de aplicación de los fungicidas, así como los acrónimos que se utilizarán, se recogen en la Tabla 1.
Resultados
Los resultados realizados en las plantas una vez arrancadas se muestran en la Tabla 2. Los parámetros evaluados han sido: longitud de brotes y raíces, y volumen aéreo y de raíces. Además, se muestra, en tanto por ciento, la clasificación que el viverista realizó con las plantas para su venta como plantas de primera y de segunda.
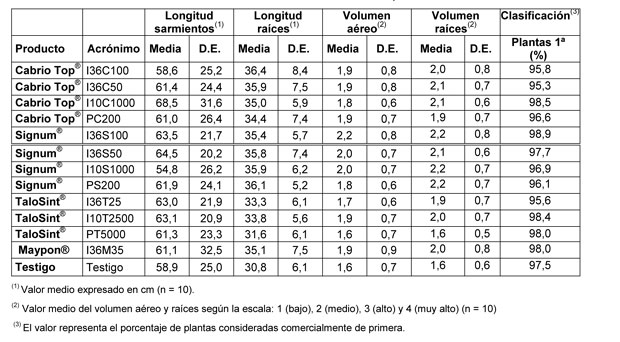
En la Figura 1 se muestra el tanto por ciento de las plantas clasificadas como plantas de primera. El viverista realiza esta clasificación para disponer de una valoración comercial de las plantas. El Anova realizado sobre la clasificación hecha en el vivero mostró que no hay diferencias significativas en el porcentaje de clasificación entre los distintos tratamientos.
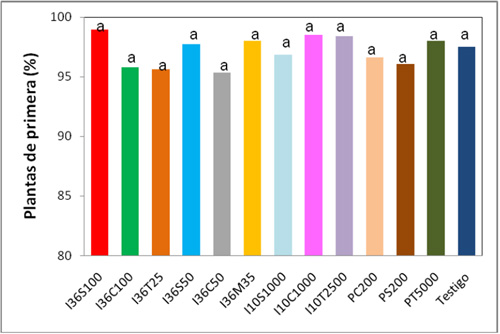
Figura 1: Clasificación de las plantas de primera.
Resultados del Análisis de Componentes Principales (PCA)
Con el fin de evaluar los resultados de las plantas obtenidas de todos los tratamientos y considerando todos los parámetros evaluados se realizó un Análisis de Componentes Principales. Los resultados se muestran en la Figura 2.
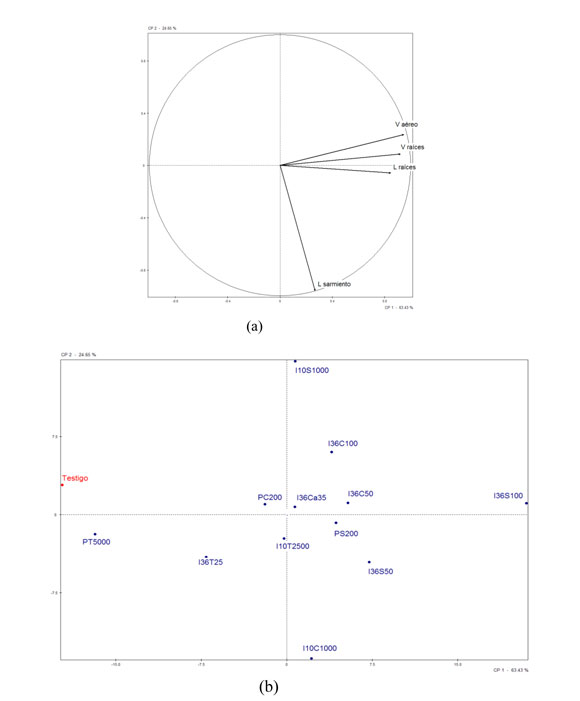
Figura 2: PCA de las dos primeras componentes: (a) proyección de las variables, (b) proyección de las muestras.
En la Figura 2 se muestra la proyección de las variables y las muestras en el plano formado por las dos primeras componentes obtenidas a partir de los datos: longitud de sarmiento, raíz, volumen aéreo y volumen de raíz. La gráfica del PCA contiene el 88% de la varianza original y puede utilizarse para tener una idea del efecto que han tenido los tratamientos realizados a las plantas del vivero. Como se muestra en la Figura 2 del PCA la mayoría de los tratamientos aplicados modificaron las características evaluadas en las plantas. Las plantas sometidas a una pulverización con TaloSint han resultado las más similares a las plantas testigo. Las plantas sometidas al resto de los tratamientos vieron modificado alguno o varios de los parámetros evaluados en las plantas. Estas muestras tienen valores de la componente 1 mayores que la muestra testigo, es decir, todas las muestras mostraron mayor longitud de raíces, volumen aéreo y volumen de raíz. Así mismo, puede observarse que la inmersión durante 36 horas con 100 g/hl de Signum y la inmersión de 10 segundos con 1000 g/hl de Cabrio Top son los tratamientos que proporcionaron plantas con mayor longitud de raíz, volumen de raíz y aéreo el primero y con mayor longitud de sarmiento el segundo.
En el caso de los tratamientos basados en la pulverización, la realizada con Signum 200 dio lugar a las plantas con mayor longitud de raíz, volumen aéreo y de raíz. TaloSint parece ser el compuesto menos efectivo de los tres productos fitosanitarios objeto de estudio en cualquiera de los métodos de aplicación de producto utilizados.
Conclusiones
Del análisis de los resultados obtenidos y teniendo en cuenta que todas las plantas fueron tolerantes a todos los productos empleados y que en ningún caso se detecto fototoxicidad en las mismas, pueden establecerse las siguientes conclusiones:
La aplicación de TaloSint, en concreto mediante pulverización, dio lugar a plantas muy similares a las plantas testigo. La aplicación de Signum en inmersión durante 36 horas con 100g/hl dio lugar a plantas con mayor longitud de raíces, volumen aéreo y volumen de raíces. La aplicación de cabrio Top mediante inmersión durante 10 segundos proporcionó plantas con la mayor longitud de sarmiento. El resto de los tratamientos no mostraron diferencias importantes entre si pero todos ellos dieron lugar a plantas con mayor longitud de raíces, volumen aéreo y volumen de raíces que las plantas testigo.
Los productos Cabrio Top y Signum han mostrado ser efectivos y su aplicación ha proporcionado plantas con mayor vigor que las plantas testigo. TaloSint ha sido el producto menos efectivo de los tres.
- Armengol, J., Vicent, A., Torné, L., García-Figueres, F., García-Jiménez, J. (2001). Hongos asociados a decaimientos y afecciones de madera en vid en diversas zonas españolas. Bol. San. Veg. Plagas 27: 137-153.
- Chiarappa, L. (2000). Esca (black measles) of grapevine. An overview. Phytopathologia Mediterranea 39: 11-15.
- Dubos, B. (1999). Maladies crytogamiques de la vigne: champignons parasites des organes herbacés et du bois de la vigne. Files et fils. Bordeaux, Francia.
- Graham, A. (2007). Integration of hot water treatment with biocontrol treatments improve yield and sustainability in the nursery. The Australian & New Zealand Grapegrower & Winemarker 524: 33-39.
- Graniti, A., Surico, G., Mugnai, L. (2000). Esca of grapevine: a disease complex or a complex of diseases?. Phytopathologia Mediterranea 39: 16-20.
- Larignon, P. (2007). Bilan de travaux et des recherches sur les maladies du bois par l'IFV Institut Français de la Vigne et du Vin 2.002-2.007.
- Rego, C., Nacimento, T., Cabral, A., Oliveira, H. (2004). Doencas do Lenho. I S A, L P V V A (Ponte de Lima).
- Waite, H., Brodie, G., Dyson, T. (2007). Microwave treatment of grapevine cuttings – a possible alternative to hot water treatment. The Australian & New Zeland Grapegrower & Winemarker 519: 35-37.





















