Estrategias enológicas para la prevención del gusto de luz en vinos blancos
El gusto de luz se relaciona con la formación de compuestos volátiles de azufre (Haye et al., 1977, Maujean et al., 1983a). El metantiol y el disulfuro de dimetilo (DMDS) parecen ser, en gran parte, los responsables del aroma a col hervida en vinos blancos afectados por este defecto (Maujean et al., 1983a). La exposición a la luz también puede influir en la producción de otros compuestos de aroma indeseable como el furfural (Jung et al.; 2007) que se ha correlacionado positivamente con el aroma de verdura hervida en vinos blancos almacenados en condiciones que favorecen la oxidación (Escudero et al., 2002). Estudios en vino sintético sugieren que la exposición a la luz puede aumentar la velocidad de oxidación de etanol a acetaldehído (Clark et al., 2007). Además, la luz puede acelerar el pardeamiento de vinos blancos embotellados en botellas transparentes o de colores claros (Dias et al., 2013, Dias et al., 2012)
La mayoría de los vinos blancos puede desarrollar el gusto de luz (Mattivi et al., 2000, Pichler, 1996). La susceptibilidad de los vinos blancos para desarrollar este defecto se ha asociado con la riboflavina (RF).
La riboflavina (vitamina B2) está presente en la naturaleza como mononucleótido de flavina (FMN), dinucleótido de flavina adenina (FAD) y riboflavina (RF). Aunque se han encontrado las tres formas en zumos de frutas y cervezas, solamente la RF ha sido detectada en vino (Andrés-Lacueva et al., 1998). La riboflavina es un compuesto altamente fotosensible. Su degradación fotoquímica puede seguir varios caminos de los cuales la foto-reducción intermolecular es la más relevante, al hablar del gusto de luz. (Maujean et al., 1983a). El primer paso del mecanismo de degradación es la captación de un par de electrones de un dador externo (en este caso la metionina) por parte de la RF. De este modo se obtiene una flavina totalmente reducida y metional (Maujean et al., 1983a). El metional es extremadamente inestable y descompone para formar metantiol y acroleína. La reacción de dos moléculas de metantiol produce disulfuro de dimetilo (DMDS) (Maujean et al., 1983a).
La presencia de RF en el vino se debe principalmente al metabolismo de la levadura Saccharomyces cerevisiae. Es conocido que la levadura contiene un gen, RIB5, que codifica la formación de la enzima riboflavina sintasa, que interviene en el último paso de la síntesis de RF por parte de la levadura (Santos et al., 1995). Sin embargo, son pocos los datos relacionados con la producción de RF durante la vinificación.
En un estudio publicado por Pichler en 1996 se afirma que la concentración de RF 'de seguridad' es de 100 µg/L. Según Pichler, por debajo de esa concentración el gusto de luz o no se produce p no se detecta. Además, en esa publicación, se presentan los primeros resultados publicados acerca de la reducción de RF por medio de agentes clarificantes, en concreto, bentonita.
Este artículo se centra, en primer lugar, en confirmar que las levaduras son, en efecto, responsables del aumento del contenido de RF en los vinos. En segundo lugar, en determinar la cinética de degradación de la RF tanto en vino sintético como en vino blanco expuesto a la luz en las longitudes de onda de absorción de la RF (370 y 440 nm). Y, por último, en probar la eficacia de diferentes agentes de clarificación y coadyuvantes (diferentes tipos de bentonita, carbón activo, zeolita…) con el fin de disminuir el contenido de RF.

1. Materiales y métodos
1.1 Productos y reactivos
El metanol, etanol, acetonitrilo, riboflavina (RF), ácido cítrico, tetrahidrofurano (THF), ácido bórico, mercaptoetanol, o-ftalaldehído (OPA), aminoácidos y el ácido clorhídrico se obtuvieron de Sigma-Aldrich (St. Louis, MO, EE UU). El agua para los análisis por HPLC se obtuvo mediante un sistema Milli-Q (Millipore Filter Corp., Bedford, MA, EE UU).
El vino sintético contenía 5,0 g/L de ácido tartárico, 12% de etanol (v/v), a pH 3,2 ajustado con hidróxido de sodio 12M (Merck, Darmstadt, Alemania).
1.2 Ensayos de fermentación
Se probaron quince cepas de levadura comerciales comúnmente utilizadas en la elaboración de vino (catorce S. cerevisiae y una S. bayanus).
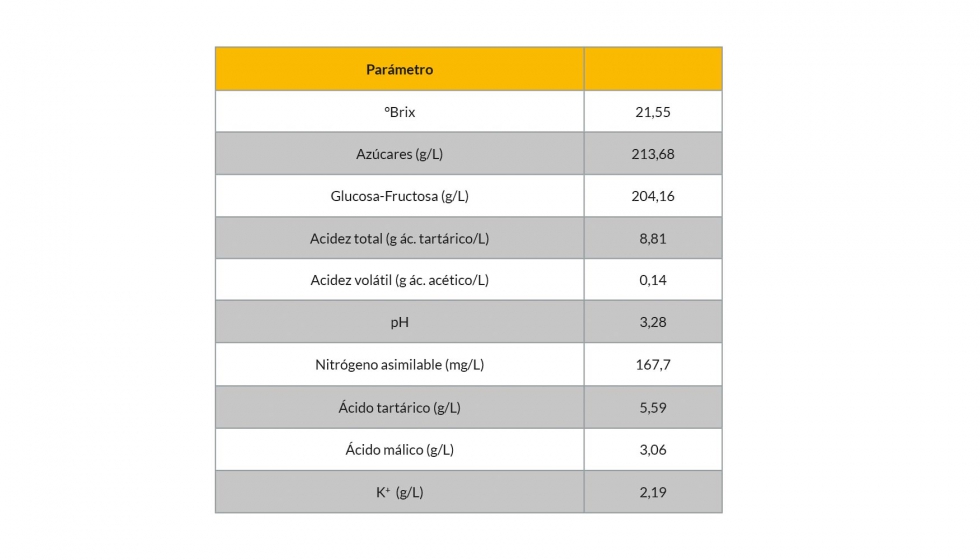
Las micro-fermentaciones se realizaron por triplicado utilizando 200 mL de mosto Chardonnay, producido en la vendimia de 2014, al que se añadieron 300 mg/L de fosfato de amonio para asegurar tasas de fermentación regulares. La composición química del mosto se muestra en la Tabla 1. Las quince cepas de levadura utilizadas se rehidrataron de la misma forma disolviendo 2 gramos en 20 ml de agua (T = 38 °C). Después de 10 minutos de agitación, la levadura se dejó reposar durante 10 minutos. Finalmente, cada cepa de levadura se inoculó en el mosto (106 cfu/ml). Dos de las muestras de cada una de las cepas de levadura se mantuvieron en botellas de vidrio de color marrón y una en un matraz Erlenmeyer tapado con una válvula de Müller. Las muestras se mantuvieron en un termostato a 18 °C y las fermentaciones fueron monitorizadas por la pérdida de peso de los matraces Erlenmeyer día a día.
Además, otros tres ensayos de fermentación se realizaron utilizando la misma cepa de levadura (la número 10) y en las mismas condiciones que las anteriores. A uno de estos ensayos se le añadieron 30 g/hL de una fuente de nitrógeno parcialmente soluble (P1) consistente en células de levadura inactivadas. Al otro ensayo se le añadió un nutriente distinto (P2), que contenía sólo la parte citoplasmática de la levadura. El tercer ensayo sirvió de control. Estos ensayos fueron tratados y controlados como los anteriores.
1.3 Cinética de degradación de la riboflavina
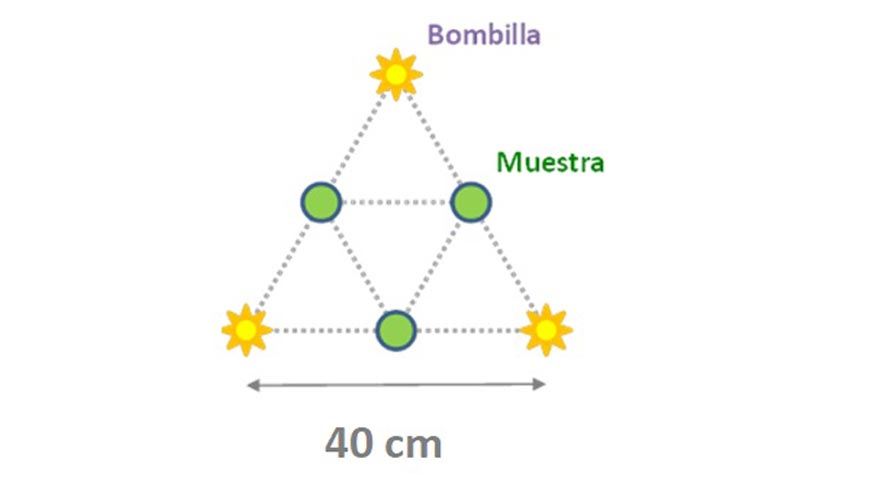
La cinética de degradación de la RF se estudió tanto en vino sintético como en un vino blanco de la variedad Chardonnay (vendimia 2014). La concentración de RF se ajustó en el vino sintético hasta 400 µg/L. El vino Chardonnay contenía 175 µg/L de RF de partida por lo que el contenido no se incrementó. La iluminación se llevó a cabo usando un aparato con un alto flujo luminoso y alta emisión en las longitudes de onda de absorción de la RF (370 y 440 nm) (Figura 1). El aparato se componía de un triángulo de 40 cm de lado con 3 bombillas fijadas en los tres vértices. Las bombillas utilizadas fueron lámparas fluorescentes compactas de 55W (Lexman), con emisión de luz fría (6.500 K) y con un flujo luminoso de 3172 lumen. Este aparato experimental permitió el tratamiento de tres muestras a la vez poniendo una muestra en el centro de cada lado. El tipo de lámpara utilizado tiene líneas de emisión intensas en las dos principales longitudes de onda de absorción de la RF, especialmente a 440 nm. El sistema siempre estaba cubierto con una caja sin la parte superior para evitar el efecto de la temperatura.
Las muestras se iluminaron durante cuatro horas y se retiraron muestras a los 30, 60, 120, 240 y 480 minutos. De todas estas muestras se midió la concentración de RF.
1.4 Ensayos para reducir la concentración de riboflavina
Diferentes agentes clarificantes y coadyuvantes se ensayaron en un vino sintético con un contenido en RF de 350 µg/L. Los agentes clarificantes y coadyuvantes incluyen cuatro tipos de bentonitas cálcicas y dos tipos de bentonitas de sodio, dos tipos de carbón activo, zeolita, PVPP, caolín, una suspensión coloidal de sílice pura y albúmina de huevo (Dal Cin).
Los seis tipos de bentonita usadas en estos ensayos se diferencian principalmente por el tipo (sodio o cálcico), y el tipo de activación:
- Bentonita 1: bentonita cálcica obtenida a partir de materia prima europea. Activado mediante el intercambio de sodio-calcio siguiendo procedimientos químicos y físicos.
- Bentonita 2: bentonita cálcica obtenida a partir de materia prima asiática. Activado mediante el intercambio de sodio-calcio siguiendo procedimientos químicos y físicos.
- Bentonita 3: altamente activa (activación química), bentonita de sodio, materia prima europea.
- Bentonita 4: altamente activa (activación química), bentonita de sodio, materia prima asiática.
- Bentonita 5: altamente activa (activación física y química), bentonita de sodio, materia prima europea.
- Bentonita 6: altamente activa (activación física y química), bentonita de sodio, materia prima asiática.
Los dos tipos de carbón activo utilizado en estos ensayos se diferencian principalmente por el tamaño de poro (superficie específica) y del tipo de activación:
- Carbón 1: tamaño de poro grande, activado químicamente.
- Carbón 2: tamaño de poro más pequeño que el número 1, activado físicamente.
Los ensayos se llevaron a cabo con todos los tipos de bentonita (100 g/hL), el caolín (100 g/hL), la suspensión coloidal de sílice (100 g/hL) y la PVPP (10, 40 y 80 g/hL). La albúmina de huevo se ensayó a 10 g/hL mezclada con bentonita a 100 g/hL. La albúmina de huevo también se ensayó disolviéndola a diferentes pH: se realizó una prueba de disolución con agua (pH final 6,7) y la otra disolviendo la albúmina en una solución al 1% de carbonato de sodio (pH final 10,4). Todos estos ensayos fueron considerados preliminares y se realizaron de forma individual. Tras estos ensayos se realizaron pruebas por triplicado solamente con la bentonita 6 a 10, 50 y 100 g/hL, la zeolita a 100 g/hL y ambos tipos de carbón a 0,5, 1, 2, 5 y 10 g/hL.
Las suspensiones de los diferentes tipos de bentonita, zeolita, caolín y la solución de albúmina de huevo (5%) se prepararon con agua y se agitaron durante al menos una hora para obtener una buena dispersión/disolución e hidratación del producto. Después, se añadieron diferentes volúmenes al vino sintético (250 ml) dependiendo de la concentración deseada. El carbón y la PVPP fueron añadidos directamente al vino sintético. Todas las muestras se agitaron durante 15 minutos y después se dejaron tapadas y en la oscuridad durante 24 horas.
1.5 Cuantificación de la riboflavina
El método utilizado para la determinación de riboflavina fue una modificación del descrito por Amidžic et al. (2008). La RF en vino sintético y vino fue analizada por UHPLC con detección UV. Se utilizó un sistema Acquity UPLC HClass (Waters, Milford, MA, EE UU) equipado con un detector DAD 2996 (Waters). La longitud de onda de detección seleccionada fue de 440 nm. Las muestras se pasaron a través de un filtro de 0,22-µm, y alícuotas de 50 µL se inyectaron directamente, sin preparación de muestra, en una columna Hypersil ODS C18 de 100 mm x 3,0 mm, con un tamaño de partícula de 3 micras (CPS Analitica, Milán, Italia) mantenida a 25 °C. La composición de la fase móvil fue: 90% de tampón 50 mM de citrato a pH 2,5 y 10% de metanol (A) y 10% de tampón citrato 50 mM a pH 2,5 y 90% de metanol (B).
2. Resultados y discusión
2.1 Ensayos de fermentación
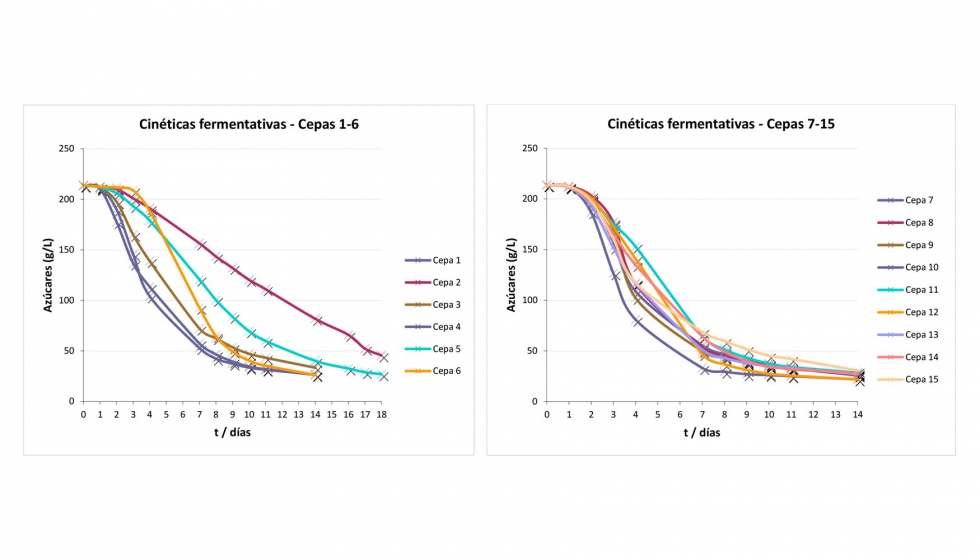
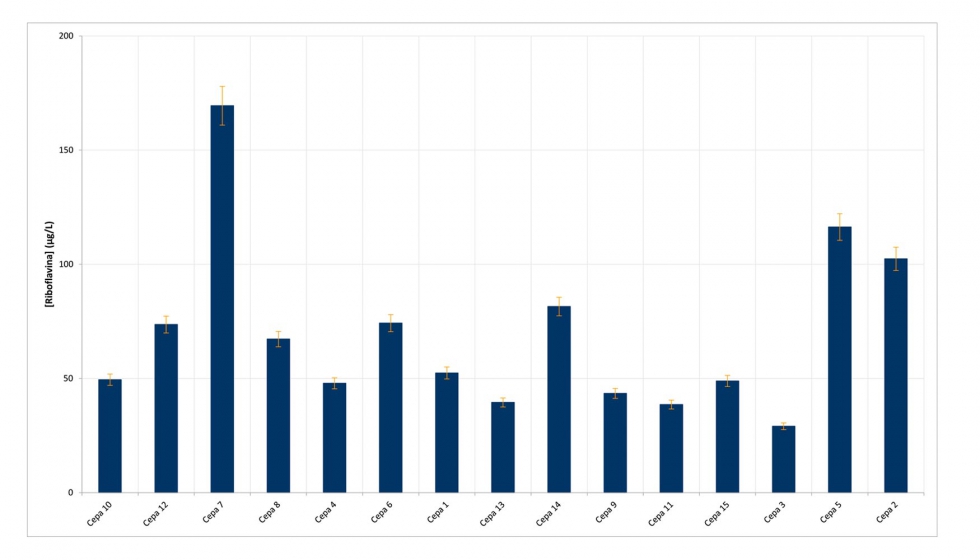
La riboflavina está presente naturalmente en las uvas y en consecuencia en el mosto aunque a bajas concentraciones (3-60 µg/L) (Ribéreau-Gayon et al., 1975). Su contenido en el vino puede estar relacionado con el metabolismo de la levadura por lo que se evaluó la producción de esta vitamina por parte de 15 cepas de levadura utilizadas comúnmente en la elaboración de vino. Estas cepas se utilizaron para fermentar un mosto Chardonnay con una concentración de RF inferior a 5 µg/L. La mayoría de las cepas utilizadas completó la fermentación alcohólica en, aproximadamente, 14 días (Figura 2) y sólo para las cepas 1 y 2 la fermentación alcohólica fue más larga (18 días, Figura 2A). La producción de RF es dependiente de la cepa aunque la mayoría de ellas produjeron menos de 100 µg/L de RF, concentración que se considera 'de seguridad' (Pichler, 1996) (Figura 3). Las cepas 2 y 5 presentaron concentraciones mayores a 100 µg/L (102,4 ± 6,2 µg/L y 116,3 ± 7,4 µg/L, respectivamente) y la cepa 7 fue la que más alta concentración presentó (169,5 ± 8,6 µg/L). No se observó correlación entre la velocidad de fermentación y la concentración de riboflavina. Estos resultados eran previsibles ya que el gen que codifica la formación de la riboflavina sintasa en S. cerevisiae era ya conocido (Santos et al., 1994). La selección de la cepa de levadura parece jugar un papel clave en la concentración final de RF en el vino.
Una práctica común en enología es la adición de nutrientes al mosto con el fin de evitar paradas de fermentación. Estos nutrientes a menudo contienen, entre otros, aminoácidos y vitaminas que podrían ser otra fuente de RF. Con este propósito se realizaron tres ensayos adicionales con la cepa número 10, que presentó baja producción de RF. Cuando se inoculó la levadura, se añadieron dos productos diferentes que se utilizan como fuente de nitrógeno asimilable para la fermentación a una concentración de 300 mg/L. No se encontró diferencia en la tasa de fermentación alcohólica (datos no mostrados), pero las concentraciones más altas de RF se encontraron en las muestras con nutriente añadido (72,4 ± 3,6 µg/L y 75,6 ± 4,8 µg/L para el producto 1 y 2, respectivamente) en comparación con el testigo sin adición de nutrientes (55,0 ± 3,9 µg/L). Sin embargo, no es posible afirmar que estos nutrientes favorezcan la producción de riboflavina. La causa más probable de este aumento es que los nutrientes ya contenían RF y este contenido simplemente se suma a la RF que está siendo producida por la cepa de levadura. De hecho, el producto 2 contenía 70 µg/g, correspondiente a 21 µg/300 mg, que fue el aumento de RF observado. Estos resultados demuestran que las preparaciones enológicas podrían ser una fuente de RF y el control de su composición podría ser necesaria para mantener la concentración de RF bajo el nivel seguro (Pichler, 1996).
2.2 Cinética de degradación de la RF
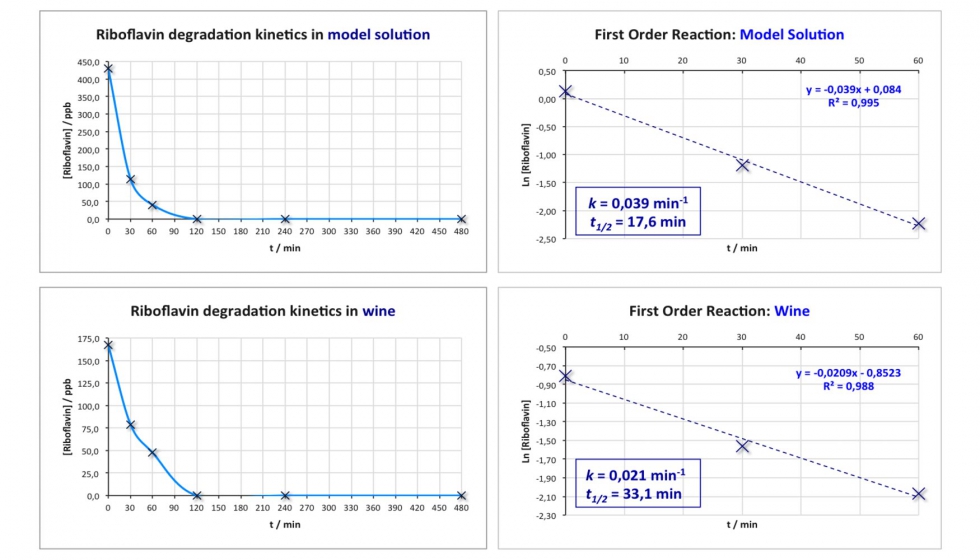
La cinética de degradación de RF se estudió tanto en vino sintético como en vino blanco, y en ambos casos no se detectó RF después de 2 horas de iluminación (Figura 4). La degradación de RF siguió una cinética de primer orden como ya había sido reportado por Maujean y Seguin (1983a). Las velocidades de reacción y los tiempos de semi-vida se calcularon en ambos casos. El tiempo de semi-vida en el caso del vino blanco (33,1 min) dobló el tiempo de semi-vida obtenido en vino sintético (17,6 min). Hay muchos factores que pueden influir en la velocidad de reacción, incluyendo la intensidad de la luz y el disolvente. En este caso, la intensidad de la luz se considera que es la misma debido a que las muestras se iluminaron con el mismo aparato y la misma cantidad de tiempo. La matriz puede explicar esta diferencia ya que los flavan-3-oles puede dificultar la formación del gusto de luz gracias a su capacidad de absorción de luz (Maujean et al., 1983a, Maujean et al., 1983b). Sin embargo, estas condiciones experimentales no se pueden comparar con la iluminación a la que es sometido un vino ya que el aparato de iluminación se desarrolló como método rápido y eficaz para estudiar la cinética de degradación de la RF.
2.3 Reducción de RF mediante el uso de clarificantes y coadyuvantes
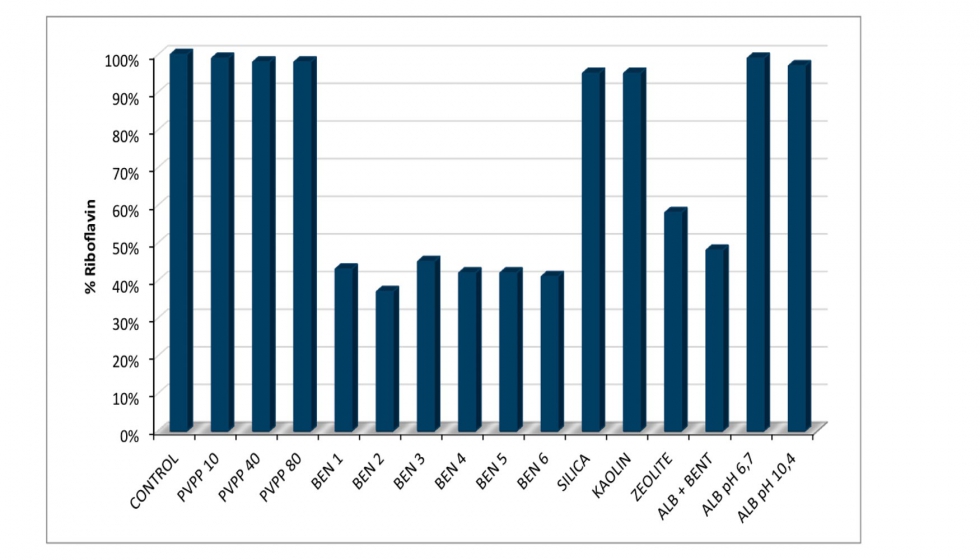
Varios agentes clarificantes y coadyuvantes se ensayaron con el fin de evaluar su eficacia en la disminución de la concentración de RF en vino sintético. Como se muestra en la Figura 5, después de 24 horas las seis bentonitas parecían comportarse igual en la reducción de RF. La reducción promedio de RF fue del 60% y fue similar a los resultados obtenidos por Pichler (1996). No se encontraron diferencias entre bentonitas sódicas y cálcicas. La zeolita mostró una reducción en el contenido de RF de casi el 50%. Este agente de clarificación no ha sido aceptado todavía por la OIV para el uso enológico, aunque ha sido estudiado como un sustituto de la bentonita en la clarificación de vino blanco para mejorar la estabilidad proteica y tartárica (Mercurio et al., 2010). La albúmina de huevo fue ensayada ya que Tillotson et al. (1980) reportaron que la albúmina de huevo contiene proteínas capaces de ligarse con la riboflavina (flavoproteínas). Sin embargo, la cantidad de esta flavoproteína es muy pequeña y el procedimiento de extracción es muy delicado y complicado. La albúmina de huevo se ha utilizado en la industria del vino como un agente de clarificación para asegurar la estabilización de las proteínas (Riberau-Gayon et al., 2006). Este agente clarificante sólo funcionó bien cuando se añadió junto con bentonita y, la comparación de este resultado con los obtenidos sólo con la bentonita, parecen mostrar que la bentonita fue la responsable de la disminución de RF. Además de esto, los resultados obtenidos cuando sólo se añadió albúmina de huevo, después de la disolución a diferentes pH, mostró una disminución mínima de RF. La PVPP no parece ser eficaz en cualquiera de las concentraciones ensayadas. Similar, en el caso de la sílice y el caolín donde no se observó reducción de la concentración de RF. La sílice se utiliza a menudo como un líquido y se sabe que puede adsorber las proteínas (Riberau-Gayon et al., 2006). El caolín es una arcilla silícea, que es más compacta que la bentonita y tiene menos del 10% de las propiedades adsorbentes de ese mineral. Este hecho hace que el caolín sea menos eficaz como clarificante y serían necesarias dosis más altas para el logro de los mismos resultados que con bentonita (Hornsey, 2007).
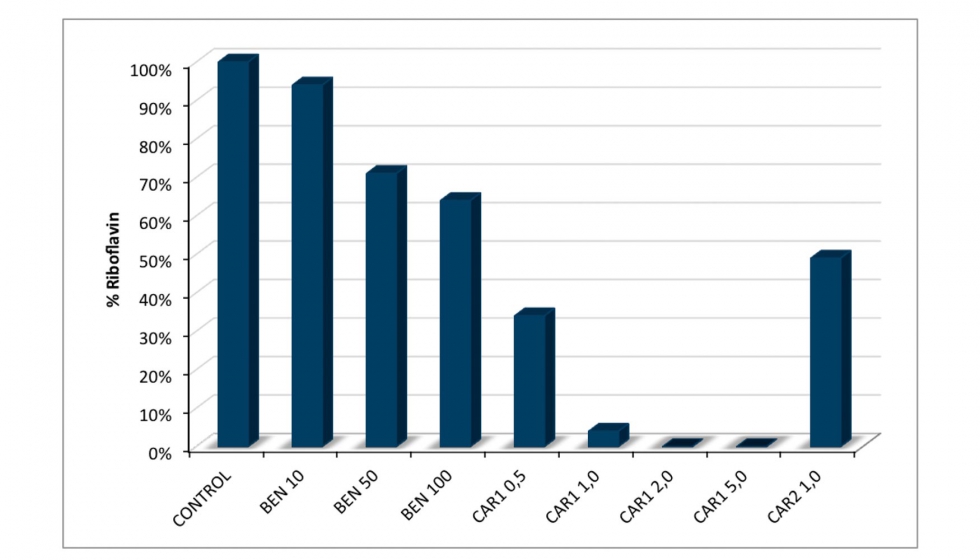
La influencia de diferentes dosis de bentonita se estudió al ser el agente clarificante que mostró una mayor eficacia en la eliminación de RF. La Bentonita 6 se ensayó de nuevo a tres concentraciones diferentes (10, 50 y 100 g/hl). Por otra parte, también se realizaron tratamientos con 2 tipos de carbón. El carbón 1 se ensayó a cuatro concentraciones diferentes (0,5, 1, 2 y 5 g/hL), mientras que el carbón 2 se ensayó sólo a 1 g / hL, ya que mostró ser menos activo que el número 1 en ensayos preliminares (datos no mostrado). La reducción de RF resultó ser dependiente de la concentración de bentonita añadida casi con una relación lineal (Figura 6). Por otro lado, el carbón activo mostró un 100% de reducción en concentraciones de 2 y 5 g/hL. A 1 g/hL la reducción de RF fue casi completa (94%) y a los 0,5 g/hL la reducción alcanzó casi un 70%. Como era de esperar, el carbón 2, siendo menos activo que el carbón 1, presentó una disminución de RF del 50%.
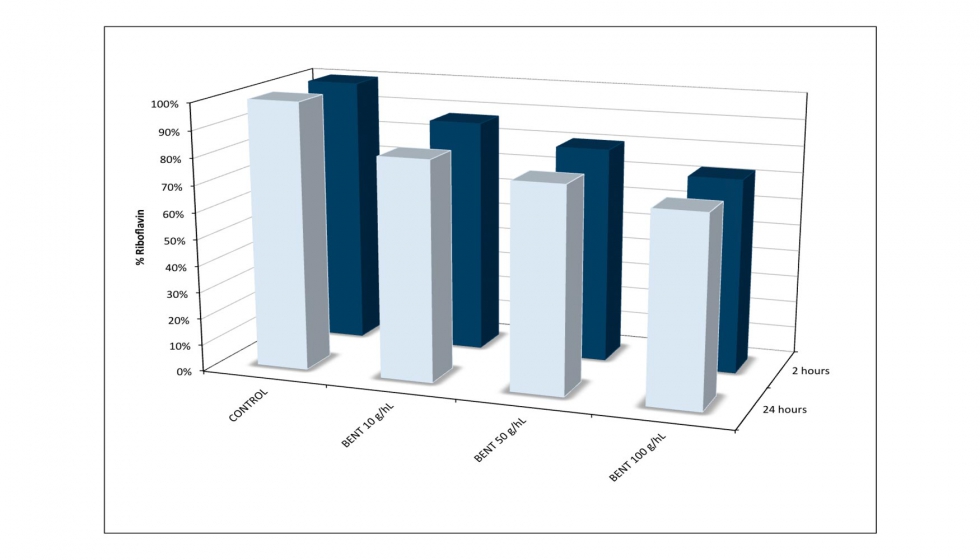
La cinética de la reducción de RF se evaluó mediante la adición de diferentes concentraciones de bentonita 6 y del carbón 1. Se tomaron muestras a las 2 y a las 24 horas. La reducción se produjo casi completamente en las dos primeras horas después de iniciar el tratamiento. Tras las dos primeras horas la reducción se puede considerar residual. En el caso de la bentonita, se obtuvo una reducción máxima del 35%, que fue inferior a la reducción previamente descrita, pero se observó la misma correlación entre la concentración de bentonita y la reducción de RF (Figura 7).
La adición de carbón activo (5 y 10 g/hL) permitió la eliminación completa de RF en 2 horas (Figura 8). Debido a que altas concentraciones de carbón pueden ser perjudiciales para las características sensoriales del vino, se ensayaron concentraciones menores de 0,5 y 1 g/hL. Las disminuciones de RF fueron aproximadamente del 90% y 70% en 24 horas para el carbono añadido en 0,5 y 1 g/hL, respectivamente.
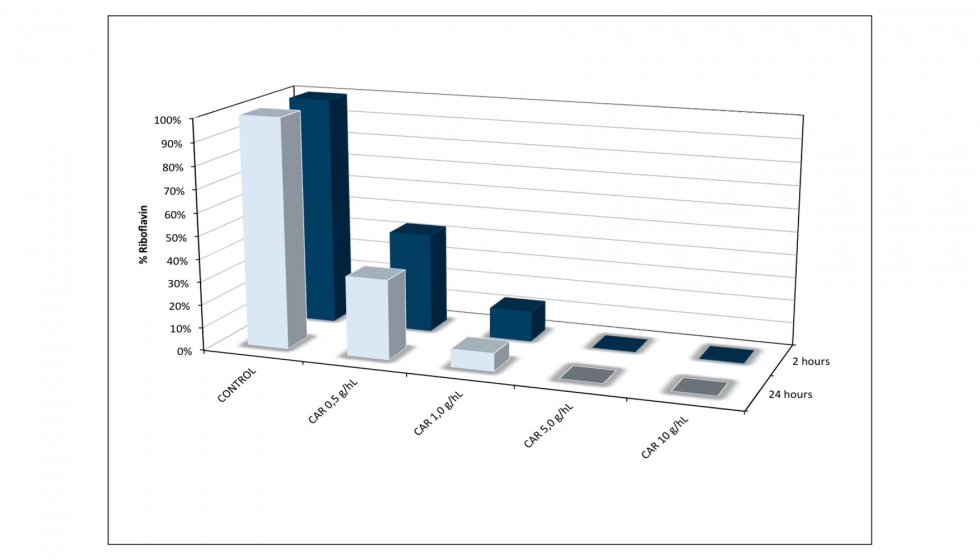
Como el carbón, la bentonita y la zeolita mostraron ser los más eficaces en vino sintético, se probaron en vino blanco. Como se esperaba, estos agentes clarificantes fueron menos eficaces en el vino, con una disminución del 10% para la zeolita (100 g/hL), 25% de bentonita (100 g/hL) y 60% para el carbón (5 g/hL). Este último se sometió a ensayos a diferentes concentraciones (Figura 9) y el 70% de reducción de RF se alcanzó cuando se añadieron 10 g/hL, 20 veces mayor en comparación con los ensayos en vino sintético. No se observó diferencia después de 2 horas y 24 horas de tratamiento.
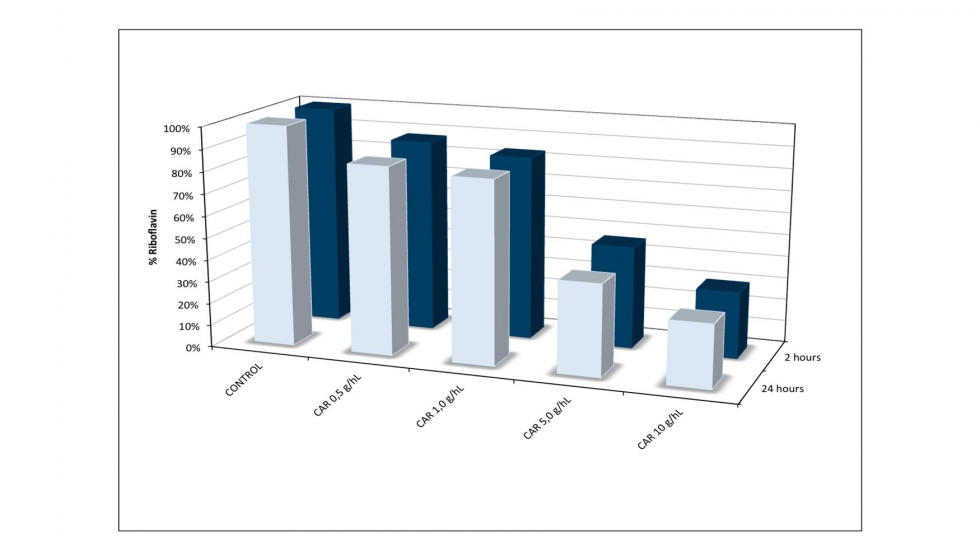
3. Conclusiones
En el presente artículo se ha mostrado como las levaduras son las principales responsables del aumento de la RF en el vino final. No obstante, esta producción parece ser cepa-dependiente por lo que es importante conocer la producción de RF de la levadura antes de vinificar un vino que se pretende embotellar en vidrio transparente. Además, es importante comprobar qué composición tienen los nutrientes empleados durante la fermentación alcohólica ya que muchos de ellos contienen RF en sus formulaciones.
La cinética de degradación de la RF es rápida. Es cierto que es más rápida en vino sintético que en vino y que las condiciones de iluminación empleadas en este estudio son mucho más agresivas que la iluminación a la que se somete una botella en, por ejemplo, el lineal de un supermercado. Sin embargo se ha comprobado que, en tan solo dos horas, la RF se degrada completamente en las condiciones de este estudio.
Si no se puede evitar la acumulación de RF en el vino, se ha visto que la clarificación es un método efectivo para reducir el contenido de RF. Los mejores resultados se han obtenido con bentonita y, sobre todo, con carbón activo. Ciertamente las concentraciones de clarificante utilizadas han sido altas y resultaría incluso contraproducente, para la calidad sensorial del vino, en según qué casos.
Con todo, si lo que se pretende es evitar la aparición de defectos relacionados con la exposición a la luz, lo más seguro y eficaz es embotellar en botellas de vidrio oscuro que filtran en un porcentaje muy alto las longitudes de onda que degradan la RF. Sólo en el caso en que el marketing mande cabe tener en cuenta lo expuesto en este estudio para minimizar el riesgo de la aparición del gusto de luz.
Bibliografía
- 1. Amidžic, D., Klaric, I., Jasprica, I.; Vedrina-Dragojevic, I. Determination of water soluble vitamins in blackberry wines using high-performance liquid chromatography. 14th International Symposium on Separation Sciences: New achievements in chromatography: book of abstracts, 2008. 144-144.
- 2. Andres-Lacueva C., Mattivi F., Tonon D., Determination of riboflavin, flavin mononucleotide and flavin–adenine dinucleotide in wine and other beverages by high-performance liquid chromatography with fluorescence detection. J. Chromatogr. A, 823 (1998) 355-363.
- 3. Bekbölet, M. (1990). Light effects on food. Journal of Food Protection, 53: 430-440.
- 4. Clark, A. C., Dias, D. A., Smith, T. A., Ghiggino, K. P., Scollary, G. R. (2011). Iron(III) tartrate as a potential precursor of light induced oxidative degradation of white wine: Studies in a model wine system. Journal of Agricultural and Food Chemistry, 59: 3575-3581.
- 5. Clark, A. C., Prenzler, P. D., Scollary, G. R. (2007). Impact of the condition of storage of tartaric acid solutions on the production and stability of glyoxylic acid. Food Chemistry, 102: 905-916.
- 6. Dias, D. A., Clark, A. C., Smith, T. A., Ghiggino, K. P., Scollary, G. R. (2013). Wine bottle color and oxidative spoilage: Whole bottle light exposure experiments under controlled and uncontrolled temperature conditions. Food Chemistry, 138: 2451-2459.
- 7. Dias, D. A., Smith, T. A., Ghiggino, K. P., Scollary, G. R. (2012). The role of light, temperature and wine bottle colour on pigment enhancement in white wine. Food Chemistry, 135: 2934-2941.
- 8. Escudero, A., Asensio, E., Cacho, J., Ferreira, V. (2002). Sensory and chemical changes of young white wines stored under oxygen. An assessment of the role played by aldehydes and some other important odorants. Food Chemistry, 77: 325-331.
- 9. Escudero, A., Hernández-Orte, P., Cacho, J., Ferreira, V. (2000). Clues about the role of methional as character impact odorant of some oxidized wines. Journal of Agricultural and Food Chemistry, 48: 4268-4272.
- 10. Haye, B., Maujean, A., Jacquemin, C., Feuillat, M. (1977). Contribution a l’étude des “goûts de lumière” dans le vin de Champagne. I. Aspects analytiques. Dosage des mercaptans et des thiols dans les vins. Connaissance de la Vigne et du Vin, 11: 243-254.
- 11. Hornsey, I. (2007). The Chemistry and Biology of Winemaking. RSC Publishing, Cambridge, UK.
- 12. Jung, R., Hey, M., Hoffmann, D., Leiner, T., Patz, C. D., Rauhut, D., Schüssler, C., Wirsching, M. (2007). Lichteinfluss bei der Lagerrung von Wein. Mitteilungen Klosterneuburg, 57: 224-231.
- 13. Mattivi, F., Monetti, A., Vrhovšek, U., Tonon, D., Andrés-Lacueva, C. (2000). High-performance liquid chromatographic determination of the riboflavin concentration in white wines for predicting their resistance to light. Journal of Chromatography A, 888: 121-127.
- 14. Maujean, A., Haye, M., Feuillat, M. (1978). Contribution a l’étude des “goûts de lumière” dans le vin de Champagne. II. Influence de la lumière sur le potentiel d’oxydoreduction. Correlation avec la teneur en thiols du vin. Connaissance de la Vigne et du Vin, 12: 277-290.
- 15. Maujean, A., Seguin, N. (1983a). Contribution a l’étude des goûts de lumière dans les vins de Champagne. 3. Les réactions photochimiques responsables des goûts de lumière dans le vin de Champagne. Sciences des Aliments, 3: 589-601.
- 16. Maujean, A., Seguin, N. (1983b). Contribution a l’étude des goûts de lumière dans les vins de Champagne. 4. Approaches a une solution œnologique des moyens de prévention des goûts de lumière. Science des Aliments, 3: 603-613.
- 17. Mercurio, M, Mercurio, V., de Gennaro, B., de Gennaro, M., Grifa, C., Langella, A., Morra, V. (2010). Natural zeolites and white wines from Campania region (Southern Italy): a new contribution for solving some oenological problems. Periodico di Mineralogia, 79: 95-112.
- 18. Pereira, V., Pontes, M., Câmara, J.S., Marques, J.C. (2008). Simultaneous analysis of free amino acids and biogenic amines in honey and wine samples using in loop orthophtaladeyde derivatization procedure. Journal of Chromatography A, 1189; 435-443.
- 19. Pichler, U. (1996). Analisi della riboflavina nei vini bianchi e influenza della sua concentrazione. Enotecnico, 32: 57-62.
- 20. Ribéreau-Gayon, P., Dubourdieu, D., Donèche, B., Lonvaud, A. (2006). Handbook of Enology. Volume 1. The Microbiology of Wine and Vinifications. 2nd Edition. John Wiley & Sons, Ltd.
- 21. Santos MA, García-Ramírez JJ, Revuelta JL. Riboflavin biosynthesis in Saccharomyces cerevisiae. Cloning, characterization, and expression of the RIB5 gene encoding riboflavin synthase. J Biol Chem. 1995 Jan 6;270(1):437-44.
- 22. Tillotson, J.A., Bashor, M.M. (1980). Fluorometric Apoprotein Titration of Urinary Riboflavin. Analytical Biochemistry, 107: 214-219.





















