Uso de hongos micorrícicos y bacterias beneficiosas del suelo como biofertilizantes en cultivos hortícolas
En la actualidad, ya sea por motivos medioambientales o económicos, los microorganismos promotores del crecimiento vegetal (PGPR), así como los hongos formadores de micorrizas arbusculares (MA), van ganando terreno al uso indiscriminado de productos químicos como fertilizantes. En el presente trabajo se han seleccionado dos cepas bacterianas: Azospirillum brasilense (fijadora de nitrógeno no simbiótica y productora de auxinas) y Pseudomonas fluorescens (solubilizadora de fósforo y productora de sideróforos), y tres cepas de hongos: Funneliformis mosseae, Rhizophagus intraradices y Glomus desertícola, para su uso como biofertilizantes en cultivos de distintas especies agrícolas (tomate, pimiento, melón, lechuga, patata, ajo y cebolla), tanto en cultivos convencionales como ecológicos. El tratamiento con estas dos bacterias PGPR, produjo incrementos del peso fresco en patata (>100%), lechuga (>50%), ajo (>50%), no detectándose en cebolla. Estos incrementos se observaron tanto en cultivos de tipo convencional como ecológico, si bien fueron algo superiores en los ecológicos (patata y ajo). Los resultados obtenidos en el cultivo de plantas de tomate micorrizadas mostraron un ahorro de agua del 25%, del 40% en fitosanitarios, del 25-30% en fertilizantes minerales y un aumento de la producción de un 10%. Los tratamientos con hongos micorrícicos en plantas de lechuga mostraron un aumento de la producción de un 20%. En el caso del pimiento no se observaron diferencias, probablemente porque los porcentajes de micorrización obtenidos en semillero fueron muy bajos.

Introducción
Los fertilizantes biológicos son productos que contienen microorganismos como sustancia activa que incluyen, actualmente, diferentes grupos de hongos, bacterias y algas. Entre los más usados en agricultura destacan los hongos formadores de micorrizas arbusculares y las bacterias promotoras del crecimiento vegetal, denominadas PGPR por sus iniciales en inglés (Kloepper et al. 1980).
Es extensa la bibliografía que demuestra que la introducción de una buena selección de hongos micorrícicos arbusculares (MA) en los suelos de cultivo agrícola mejora la nutrición vegetal, el crecimiento (Smith y Read 2008) y la tolerancia de las plantas frente a problemas de salinidad y sequía (Morte et al. 2000, Dell'Amico et al. 2002, Navarro et al. 2014). De forma parecida, las PGPR son un grupo heterogéneo de bacterias del suelo que pueden estimular el crecimiento de las plantas, protegerlas de enfermedades, y aumentar su rendimiento (Bhattacharyya y Jha, 2012).
A pesar del efecto beneficioso de las bacterias PGPR para las plantas, por lo general su concentración en los suelos no es lo suficientemente alta para competir con otras bacterias comúnmente establecidas en la rizosfera. Por lo tanto, puede ser de gran utilidad agronómica la inoculación de elevadas concentraciones de microorganismos con contrastada actividad PGPR (Igual et al. 2001).
Nuestro objetivo es analizar el efecto de la aplicación de tratamientos a base de bacterias con actividad PGPR, principalmente fijadoras de nitrógeno y solubilizadoras de fósforo, bien juntas o por separado, sobre el crecimiento de plantas hortícolas tales como: lechuga (Lactuca sativa, tipo iceberg), patata (Solanum tuberosum, variedad spunta), ajo morado (Allium sativum) y cebolla (Allium cepa). Y de la misma forma valorar el efecto de los hongos formadores de MA, (en una mezcla de tres especies) en el cultivo de algunas especies de plantas hortícolas.
El presente trabajo se realizó con la colaboración de Thader Biotechnology S.L., empresa de base tecnológica 'spin off' de la Universidad de Murcia, que entre otros temas se dedica a la producción de biofertilizantes, con una amplia gama de productos agrícolas basados en el uso de microorganismos como sustancia activa.
Materiales y métodos
Material bacteriano
Se utilizaron dos cepas bacterianas aisladas y seleccionadas por el equipo de investigación de Thader Biotechnology S.L.: Azospirillum brasilense (bacteria fijadora de nitrógeno no simbiótica), y Pseudomonas fluorescens (bacteria solubilizadora de fósforo). En los estudios de caracterización de estas cepas, en lo relativo a su actividad PGPR, se pudo comprobar que A. brasilense además de la fijación de nitrógeno presentaba una alta producción de auxinas (94,2 µg AIA/ml), mientras que P. fluorescens además de la solubilización de fósforo (79,2 µg P/ml) ha mostrado una gran capacidad de producción de sideróforos (31,7 µg equivalente sideróforo/ml) (Navarro-Ródenas et al. 2016).
Las bacterias se cultivaron en un caldo nutritivo (Scharlau), en los bioreactores Biostat B y Biostat C (Braun-Biotech-International). La formulación de producto final bacteriano fue en cultivo líquido, para los tratamientos de patata, ajos y cebollas; mientras que se utilizó la formulación 'polvo mojable' (mezcla del cultivo bacteriano con sustancias inertes y secado) para el tratamiento lechuga. La concentración bacteriana fue, en todos los casos, superior a 108 UFC/ml.
Material Fúngico
Se utilizaron 3 cepas fúngicas, aisladas en las provincias de Murcia y Alicante, Funneliformis mosseae, Rhizophagus intraradices y Glomus desertícola.
El inóculo está compuesto por una mezcla de sustrato, raíces cortas micorrizadas y esporas y se produce en jardineras utilizando el sorgo como planta trampa para completar su ciclo. En todos los casos, la inoculación se realizó en semillero, mezclando el inóculo con el sustrato de siembra. Las plantas utilizadas fueron tomate, lechuga, melón y pimiento.
Se ensayaron distintas reducciones en fertilización y riego para evaluar su efecto en plantas micorrizadas y no micorrizadas.
La metodología seguida para la revisión del estado micorrícico, en todas las plantas estudiadas, consiste en un lavado y separación del sistema radical, tinción de estas raíces con azul tripán (Phillips y Hayman, 1970) y cuantificación del porcentaje de micorrización (Giovanetti y Mosse, 1980).
Tratamientos bacterianos
Lechuga
La experiencia tuvo lugar en la finca Las Norias, en Huércal-Overa, localizada en Almería. La parcela objeto de estudio se localiza en la Finca El Romeral, donde se cultivó la planta objeto del estudio mediante agricultura convencional. El marco de plantación fue de 0,30x0,90 m. Se ha realizado rotación de cultivos con melón o lechuga y el sistema de riego fue por goteo.
Se utilizó como especie objeto de estudio Lactuca sativa, tipo iceberg. Se han estudiado 3 hectáreas, una de control sin tratamiento con bacterias, otra con P. fluorescens (P) y otra con A. brasilense (N) con dosis de 1 kg/ha en su formulación 'polvo mojable', a lo largo del ciclo del cultivo se realizaron 2 aplicaciones, mediante el riego por goteo con 30 días de intervalo. Paralelamente, durante el ciclo de cultivo, la parcela fue tratada con fertilizantes: estiércol, nitrato amónico, calcitrón, potasa complejada, complejo fósforo y ácido nítrico, y fitosanitarios: Steward, Moller balg, Altacor, extracto cítrico, N. equisetum, Urzac 60.
Se recogió un único muestreo una semana previa a la cosecha, de cada tratamiento se recogieron 20 muestras, y se calculó el peso fresco de cada lechuga.
Patata
La experiencia tuvo lugar en una finca de agricultura ecológica en el Cabezo de la Plata, Sucina, Murcia. El marco de plantación fue de 35.000-66.000 tubérculos/ha, presenta rotación de cultivos, siendo la última plantación con tomate, y el tipo de agricultura es ecológica. El riego es por goteo, teniendo lugar 2-3 veces por semana. Como finca ecológica se utiliza productos permitidos por la legislación vigente contenida en el Reglamento CEE nº 2092/91 del Consejo de 24 de junio de 1991 sobre la producción agrícola ecológica.
Se utilizó como especie objeto de estudio, Solanum tuberosum var. spunta. Para cada tratamiento se utilizó una fila con 35 plantas, una de control sin adición de bacterias otra con P. fluorescens (P) y otra con A. brasilense (N), con dosis de 1 litro/ha en su formulación de cultivo líquido. A lo largo del ciclo del cultivo se realizarán 3 aplicaciones de forma manual, cada una de ellas con 30 días de intervalo (Figura 1).
De cada tratamiento, de un total aproximado de 35 plantas/tratamiento, se recogieron los tubérculos de 10 plantas. Se tomaron datos de la producción por tratamiento y del peso medio de las patatas.

Ajo morado
Los estudios tuvieron lugar en las fincas siguientes: Ajo morado en cultivo convencional en la finca Casa Grande, Barrax, Albacete, con una superficie de 96 hectáreas; y en cultivo ecológico en la finca de la Hoya del Conejo, Robledo (Albacete), con una superficie de 24 hectáreas. El riego fue por aspersión.
Las dosis de inóculo de bacterias fueron de 1 litro de P. fluorescens y otro de A. brasilense conjuntos (N+P) por hectárea, en cada una de las tres aplicaciones realizadas mediante el riego por aspersión, cada una de ellas con 30 días de intervalo. Se trataron con bacterias dos hectáreas de cada finca, con el fin de observar las posibles diferencias en el crecimiento y producción con respecto al resto de superficie no tratada (control).
Paralelamente, durante el ciclo de cultivo, la parcela fue tratada con los siguientes productos:
Ajo morado en cultivo convencional: Triple 15/15N-15P-15K, Entec 26/26% nitrógeno total (fertilizantes) y Mextrol/Ioximil 22,5% (herbicida). Ajo morado en cultivo ecológico: Venus Vitop/6N-7P-7K (fertilizante ecológico).
Los muestreos se realizaron una semana antes del comienzo de la cosecha. Se cogieron al azar 50 plantas en cada uno de los casos, y se procesaron como es habitual en la industria del ramo, es decir, se dejaron secar durante 10 días y se les cortaron las hojas y las raíces. Posteriormente, cada cabeza de ajos fue pesada.
Cebolla
El estudio se realizó en la finca Casa Grande, en Barrax, Albacete, con una superficie cultivada de 28 hectáreas, donde se cultivó la planta objeto del estudio mediante agricultura convencional.
Las dosis de inóculo de bacterias fueron de 1 litro de P. fluorescens y otro de A. brasilense conjuntos (N+P) por hectárea, en cada una de las tres aplicaciones, realizadas mediante riego por aspersión, cada una de ellas con 30 días de intervalo. Se trataron con bacterias dos hectáreas, con el fin de observar las posibles diferencias en el crecimiento y producción con respecto al resto de superficie no tratada con bacterias (control).
Paralelamente, durante el ciclo de cultivo, la parcela fue tratada con los siguientes productos: Triple 15/15N-15P-15K, Entec 26/26% nitrógeno total (fertilizantes) y Mextrol/Ioximil 22,5% (herbicida).
Los muestreos se realizaron la misma semana de comienzo de la cosecha. Se cogieron al azar 21 plantas en cada uno de los casos (tratadas y control), posteriormente y una vez cortadas las hojas y raíces cada cebolla fue pesada
En todos los casos, a los datos obtenidos se les realizó un análisis de varianza (ANOVA) mediante el programa estadístico SPSS.

Tratamientos con hongos micorrícicos
Lechuga
Se utilizaron lechugas tipo iceberg variedad Fortunas, en cultivo ecológico. El cultivo dispuso de una manta térmica, que se retiró posteriormente. El suelo estuvo acolchado con plástico negro. El número total de plantas inoculadas fue de 102.600 plantas y la dosis de inóculo fue de 0,5 g/planta.
Tomate
Se realizaron ensayos con la variedad Boludo, a un total de 2.717 plantas. La inoculación se realizó a una dosis de 2 g/planta. Se realizaron muestreos periódicos del sistema radical.
El marco de plantación fue de 1,4 x 0,6 m, equivalente a unas 11.900 plantas /ha. Las plantas se dispusieron en caballones con plástico negro para el control de malas hierbas y mantenimiento de la humedad.
Se realizó una aportación de estiércol ovino de 5 Kg/m2 como abonado de fondo. Y como fertilizante se utilizó exclusivamente materia orgánica líquida y cuatro aplicaciones de hierro al 6%. Como tratamientos, se realizaron seis aplicaciones de azufre cúprico y dos con Bacillus thuringiensis. Se tomaron datos de producción (peso y calibre de los tomates), consumo hídrico, consumo de fitosanitarios, observaciones sobre plagas y enfermedades y mortalidad de las plantas. Además, como en todos los casos, se realizaron muestreos periódicos del sistema radical.
Melón
El ensayo de micorrización se realizó con melón Galia variedad Danubio. Se inocularon un total de 100.000 plantas a una dosis de inóculo de 2 g/planta. El marco de plantación fue de 2x0,8. Se ensayaron reducciones de fertilizantes y de agua, así como observaciones relacionadas con la sanidad vegetal y se estimó la producción en peso y nº de piezas. Paralelamente, se realizaron muestreos del sistema radical a la salida del semillero y en el momento del corte del melón.
Pimiento
En este caso, la variedad de pimiento utilizada ha sido la variedad Orlando. Se inocularon un total de 1.512 plantas, a una dosis de inóculo de 2 g/planta. La fertilización de fósforo se redujo al 50% en semillero.
Resultados y Discusión
Tratamientos bacterianos
Se observó que todos los tratamientos produjeron un incremento del peso fresco de los distintos productos agrícolas, excepto en el caso de las cebollas. Si bien estos incrementos fueron estadísticamente significativos para lechuga, patata y ajo, no se detectaron variaciones significativas para cebolla (Tabla 1).
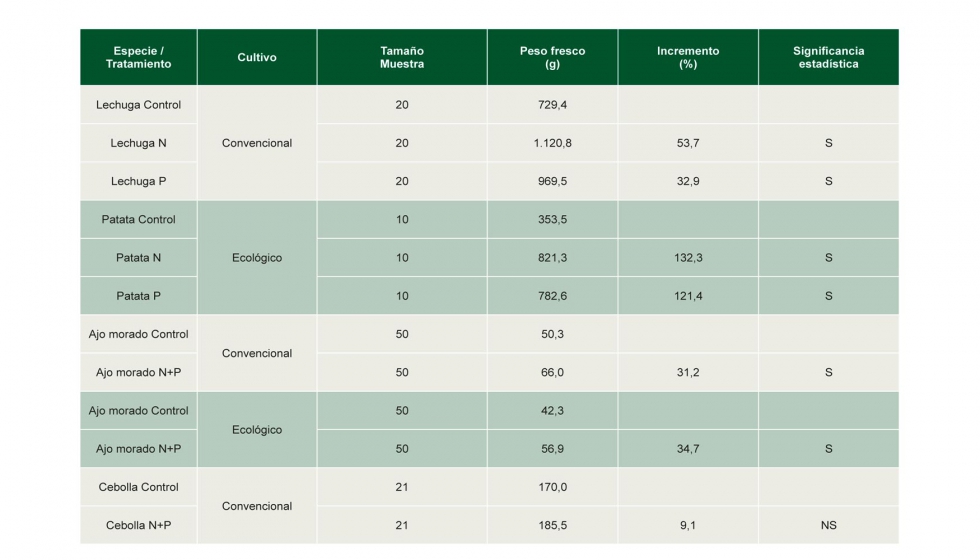
Tabla 1: Resultados de los distintos tratamientos de las especies agrícolas tratadas con biofertilizantes bacterianos (N=A. brasilense, P=P. fluorescens). S=diferencia significativa (P<0,05), NS=diferencia no significativa (P>0,05), según el test de homogeneidad de varianzas.
En cuanto a las formulaciones de presentación del producto microbiano (líquida para patata, ajo, cebolla y 'polvo mojable' para lechuga), ambas fueron efectivas, produciendo incremento de la productividad vegetal. Por otro lado, el factor que afectó más a la eficacia del tratamiento fue el método de aplicación, ya que mediante riego por aspersión (ajo y cebolla) se ha mostrado menos eficaz que por riego por goteo (lechuga), siendo la más eficaz la aplicación manual del producto directamente sobre el suelo agrícola (patata).
De estos resultados se pueden deducir que el tratamiento con PGPR fue efectivo tanto en las aplicaciones de P. fluorescens (P) y A. brasilense (N) por separado como conjuntas, excepto en cebolla. Siendo positivos tanto para cultivos convencionales como ecológicos, si bien fueron algo superiores en los ecológicos (patata y ajo).
Con estos ensayos se pretende comprobar si los efectos beneficiosos de las bacterias PGPR sobre las plantas en condiciones de laboratorio pueden ser en alguna medida extrapolables a las condiciones de campo, donde las bacterias se ven sometidas a condiciones ambientales adversas tales como altas concentraciones de contaminantes químicos, alta salinidad, pH y temperaturas extremas, presencia de organismos antagónicos ya sea por competencia por nutrientes o por antibiosis (Glick et a. 2007).
Las bacterias PGPR se pueden utilizar para facilitar el crecimiento de una gran variedad de plantas, especialmente en condiciones de estrés, y se han constituido como una alternativa al uso intensivo de fertilizantes y productos fitosanitarios químicos, los cuales además de constituir un problema medioambiental por su acumulación en suelos y aguas de drenaje, han conllevado una elevación de los costes de producción de muchos alimentos y otros derivados de la agricultura, haciéndolos poco competitivos económicamente (Franco-Correa 2009).
Por ello, la utilización de bacterias PGPR como biofertilizantes agrícolas se ha extendido sobre todo en países en vía de desarrollo, y especialmente en centro y sud-américa, baste citar algunos ejemplos como cultivos de arroz, tomates y pastos en Colombia (Bernal et al. 2000; Lara et al. 2011), arroz y sorgo en Cuba (Rives et al. 2007; Pérez et al. 2010), soja en Canadá (Freitas et al. 1997), etc.
En nuestro caso, a la vista de estos resultados, podría decirse que preliminares, creemos que las bacterias PGPR juegan un importante papel en el desarrollo de un tipo de agricultura ecológica, incrementando los rendimientos y al mismo tiempo mejorando la calidad de los suelos, tanto agrícolas como forestales.
Tratamientos con hongos micorrícicos
Los resultados obtenidos de los ensayos de micorrizaciópn con las distintas especies y en distintas condiciones muestran, en general, elevados porcentajes de micorrización, exceptuando el pimiento, como se observa en la Tabla 2.
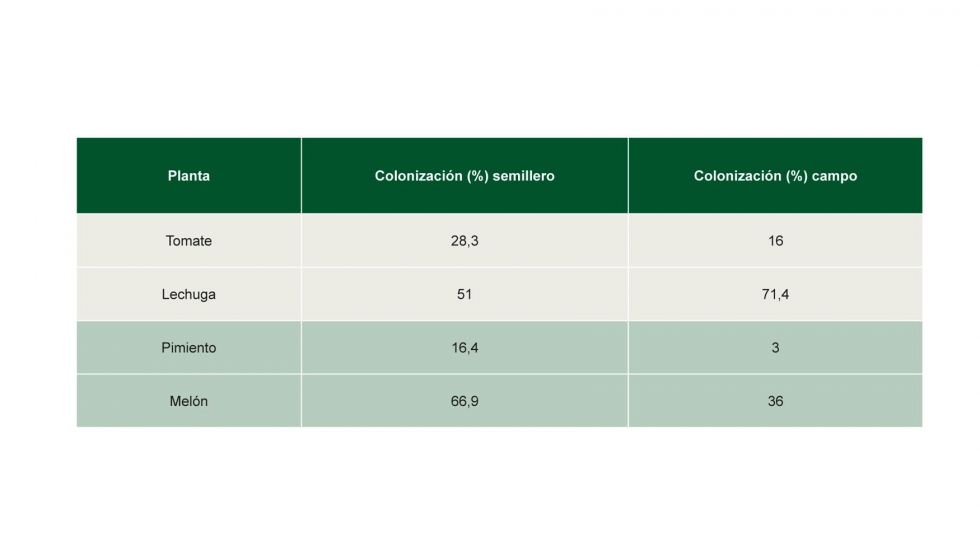
En los ensayos realizados en tomate, los resultados obtenidos en base a las observaciones a nivel de la producción mostraron que las plantas de tomate micorrizadas respecto a las plantas no micorrizadas, tuvieron un ahorro del 25% en agua de riego, del 40% en fitosanitarios, tanto de aplicación en el agua de riego como foliares y de un 25-30% en fertilizantes minerales. Con respecto a enfermedades, las plantas micorrizadas tuvieron menos ataque de patógenos, sobre todo oídio, y el porcentaje de plantas muertas por colapso fue casi nulo.
En general, las plantas de tomate micorrizadas presentaron un crecimiento y estado fisiológico y nutricional mucho más equilibrado de las no micorrizadas, lo que se tradujo en un incremento del 10% en la producción para exportación, sobre todo por el mayor calibre de los tomates al final del cultivo.
Todos los ensayos realizados con tomate han dado buenos resultados en cuanto a producción y adelanto del cuajo en la cosecha, aunque los porcentajes de micorrización no fueran demasiado elevados. A corto y largo plazo, los datos de producción de las plantas de tomate micorrizadas muestran un peso mayor en la cosecha, aunque el grado de micorrización de sus raíces en campo es bastante bajo. Otro efecto observado es que la planta micorrizada prolonga su producitividad en el tiempo; se agota posteriormente respecto de la no micorrizada.
En el caso de lechuga, los resultados muestran un 20% de peso en las plantas micorrizadas respecto a las plantas no micorrizadas, con un elevado porcentaje de micorrización. Este hecho era de esperar si se tiene en cuenta que la lechuga se utiliza habitualmente como 'planta trampa', por su rápida respuesta a la micorrización (Díaz, 1992) y debido a que su ciclo biológico se completa en 3-4 meses.
En el caso del melón, los resultados obtenidos en cuanto a la producción de las plantas micorrizadas (38,7 Tm) frente a las no micorrizadas (28,4 Tm) supuso un aumento de 10,3 Tm/ha con planta micorrizada, lo que supone un incremento del 36% de la producción. Además, se observaron otros resultados interesantes como la reducción en la fertilización fosfórica en un 100%, en la fertilización nitrogenada y potásica en un 20%, en el agua de riego de un 25% y no fue necesaria la aplicación de fungicidas.
Por el contario, los resultados obtenidos en los ensayos de micorrización en pimiento no mostraron diferencias entre las plantas micorrizadas y las no micorrizdas en cuanto a producción, sanidad, ahorro de fertilizantes, plaguicidas o agua.
En general se puede observar que el pimiento es una especie poco susceptible a la micorrización, además tiene una respuesta lenta a la colonización micorrícica, por lo que es necesario ajustar al máximo los inóculos utilizados. Se necesitarían más ensayos para controlar las ventajas que pueda representar el uso de micorrizas arbusculares en este cultivo.
De los resultados obtenidos en estos ensayos de micorrización de plantas hortícolas con hongos formadores de micorrizas arbusculares, podemos concluir que la tecnología para la introducción de micorrizas a nivel de producción se ha desarrollado con éxito en tomate, lechuga y melón. De la misma forma, la aplicación de la tecnología desarrollada puede ejecutarse, pero precisa de un cambio en los hábitos y costumbres del agricultor local. Este hecho representa el mayor hándicap para su implantación. Se deben asumir algunos cambios en agricultura, teniendo en cuenta la utilización de organismos vivos (hongos y bacterias), como son disminución de fertilizantes químicos y plaguicidas, y sobre todo, la necesidad de llevar a cabo reducciones de agua.
Por último, sería necesario seguir estudiando el comportamiento de las bacterias PGPR en cuanto a sus interacciones con los hongos MA, para llegar a concluir la presencia de relaciones sinérgicas benéficas entre estos dos grupos microbiológicos.
Referencias bibliográficas
- Bernal, J.; Valencia, P.; Guineth, S. (2000). Isolation of Enterobacteria, Azotobacter sp. and Pseudomonas sp., Producers of Indole-3-Acetic Acid and Siderophores, from Colombian Rice Rhizosphere. Revista Latinoamericana de Microbiología, 42:171-176
- Bhattacharyya P.; Jha D (2012). Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture. World J Microb Biot, 28:1327–1350.
- Dell’Amico, J., Torrecillas, A., Rodríguez, P., Morte, A., Sánchez-Blanco, M.J. (2002). Responses of tomato plants associated with the arbuscular mycorrhizal fungus Glomus clarum during drought and recovery. Journal of Agricultural Sciences 138: 387-393.
- Díaz, G. (1992). Estudio de micorrizas vesiculo arbusculares en suelos afectados por actividades mineras. Tesis Doctoral. Universidad de Murcia.
- Giovannetti, M.: Mosse, B. (1980). An evaluation of techniques for measuring vesicular- arbuscular mycorrhizal infection in rotos. New Phytol. 84:489-499.
- Franco-Correa, M. (2009). Utilización de los actinomicetos en procesos de biofertilización. Rv. peru. Biol. 16 (2): 239-242.
- Freitas, J.R.; Banerjee, M.R.; Germida, J.J. (1997). Phosphate-solubilizing rhizobacteria enhance the growth and yield but not phosphorus uptake of canola (Brassica napus L.). Biol.Fertil Soils, 24:358–364.
- Glick, B.R.; Cheng, Z.; Czarny, J.; Duan, J. (2007). Promotion of plant growth by ACC desaminase-producing soil bacteria. Eur. J. Plant Pathol. 119:329-339.
- Igual, J.M.; Valverde, A.; Cervantes, E.; Velázquez, E. (2001). Phosphate-solubilizing bacteria as inoculants for agriculture: use of updated molecular techniques in their study. Agronomie, 21:561-568.
- Kloepper, J.W.; Leong, J.; Teintze, M.; Schroth, M.N. (1980). Pseudomonas siderophores: a mechanism explaining disease-suppressive soils. Curr. Microbiol., 4:317–320.
- Lara Mantilla, C.; Oviedo Zumaqué, L.E.; Betancur Hurtado, C.A. (2011). Bacterias nativas con potencial en la producción de ácido indolacético para mejorar los pastos. Zootecnia Trop., 29(2): 187-194.
- Morte, A.; Lovisolo, C.; Schubert, A. (2000). Effect of drought stress on growth and water relations of the mycorrhizal associations Helianthemum almeriense-Terfezia claveryi. Mycorrhiza 10: 115-119.
- Navarro, J.M.; Pérez-Tornero, O.; Morte, A. (2014). Alleviation of salt stress in citrus seedlings inoculated with arbuscular mycorrhizal fungi depends on the rootstock salt tolerance. Journal of Plant Physiology 171: 76-85.
- Navarro-Ródenas, A.; Berná, L.M.; Lozano-Carrillo, C.; Andrino, A.; Morte, A. (2016). Beneficial native bacteria improve survival and mycorrhization of desert truffle mycorrhizal plants in nursery conditions. Mycorrhiza 26:769–779.
- Pérez, F.R.; Santana, R.C.; Capó, Y.A.; Martín, B.D.; Gutiérrez, R.T. (2010). Aislamiento y caracterización morfológica de bacterias endófitas en sorgo (Sorghum bicolor (L.) Moench). Revista Centro Agrícola, 37, 3: 61-66.
- Phillips, J.M.; Hayman, D.S. (1970). Improved procedures for clearing rotos and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Trans. Br. Mycol. Soc. 55:158-161.
- Rives, N.; Acebo, Y.; Hernández, A. (2007). Bacterias promotoras del crecimiento vegetal en el cultivo del arroz (Oryza sativa L.). Perspectivas de su uso en Cuba. Cultivos Tropicales, Vol. 28, No. 2: 29-38.
- Smith, S.E.; Read, D.J. (2008). Mycorrhizal Simbiosis. Third edition, Academic Press, London.